Une nouvelle publication sur la maladie d'Alzheimer se concentre sur le rôle de l'édition de l'ARN au niveau du site Q/R de GluA2 dans la régulation du nombre d'épines dendritiques des neurones et ses implications sur le déclin cognitif dans la maladie d'Alzheimer.
Une épine dendritique est une excroissance de la membrane des dendrites des neurones. Les dendrites sont des prolongements du corps cellulaire des neurones. Les épines dendritiques reçoivent les contacts synaptiques des axones des neurones présynaptiques. Bien que ces contacts puissent se faire directement sur la branche d'un dendrite, une épine dendritique constitue un espace physiquement délimité, possédant ses propres microdomaines et protéines de régulation.
 Curtiss Neveu via Wikipedia
Curtiss Neveu via Wikipedia
Les déséquilibres calciques ont longtemps été associée à la maladie d'Alzheimer, en particulier à « l'hypothèse du calcium ». Il y a de nombreuses hypothèses à propos de la maladie d'Alzheimer, celle-ci n'a pas la faveur d'une majorité de scientifiques.
On retrouve cette même hypothèse pour d'autres maladies neurodégénératives et même musculaires. En fait les scientifiques ne savent pas ce qui provoque chacune de ces maladies (Alzheimer, Parkinson, SLA), ni même si ces maladies sont si différentes l'une de l'autre d'où la tendance actuelle à rechercher des biomarqueurs puisqu'au niveau symptomes il n'est pas possible de les différencier clairement dans la vraie vie.
Les ions calcium en traversant la membrane présynaptique et la concentration de calcium à l'intérieur de la cellule conditionne la transmission de l'impulsion à travers le synapse. On pense que la majorité des récepteurs AMPA au niveau des synapses excitatrices contiennent du GluA2(R), qui sont des ions calcium imperméables au ca2+.
Des scientifiques Australiens s'efforcent de montrer dans un modèle de souris Alzheimer que l'édition de l'ARN précurseur de la protéine GluA2 serait dérégulée dans la maladie d'Alzheimer. L'édition de l'ARN modifie la perméabilité au Ca2+ et affecte donc le fonctionnement global du cerveau. L'article narre de multiples expériences et est très difficile à lire.
Les scientifiques Australiens ont donc étudié si rendre imperméable le Ca2+ en modifiant les mécanismes d'édition de l'ARN, aurait un effet positif sur des souris modèles de la maladie. Seules des souris males ont été utilisées par les scientifiques, les souris utilisées sont dérivées d'un modèle commercial (J20). Il n'est pas clair combien de souris ont été utilisées.
Les auteurs de l'étude ont codé génétiquement GluA2(R) pour empêcher le flux d'ions calcium ca2+ à travers les récepteurs AMPA contenant la protéine GluA2. Ils suggèrent que l'édition de l'ARN au niveau du site Q/R de GluA2 (un emplacement particulier dans la molécule) pourrait réguler le nombre d'épines dendritiques, à la fois chez les individus en bonne santé et chez ceux atteints de maladie d'Alzheimer.
Les scientifiques expliquent que ce site de GluA2 rend les récepteurs AMPA perméables aux ions calcium ca2+. Les récepteurs perméables aux ions calcium ca2+, résultant de GluA2(Q) non édité, sont principalement associés à des maladies. Ils ont noté une réduction significative de l’expression d’ADAR2, l’enzyme responsable de l’édition du site GluA2 Q/R, chez les souris J20 modèle de la maladie, ce qui suggère que l’édition réduite était la principale raison de la rectification actuelle modifiée.
Le codage génétique de GluA2(R) chez la souris a conduit à la restauration de la population neuronale et à une augmentation de la densité de la épine dendritique, ce qui suggère que GluA2(Q) non modifié pourrait être un facteur majeur d'anomalies dendritiques, de perte de épine dendritique et de dysfonctionnement neuronal dans les modèles de souris atteints de maladie d'Alzheimer. Les souris J20 modèle de la maladie présentent des déficits de mémoire et l'encodage de GluA2(R) a amélioré leur mémoire de travail spatiale et leur mémoire de référence spatiale.
Quelque chose qui intrigue dans la narration de ce texte est que les souris J20 modèle de la maladie d'Alzheimer ont un phénotype des crises, mais l'abolition de l'expression de GluA2 n'affectait pas le phénotype des crises. Ces crises chez les humains peuvent provoquer des clignements rapides des yeux ou un regard fixe dans le vide pendant quelques instants. Les malades peuvent aussi perdre connaissance et tomber. Ils peuvent ressentir des secousses musculaires ou des spasmes.
Le texte conclut en résumant les implications des résultats : l'édition de l'ARN au site Q/R de GluA2 peut être un mécanisme de perte de synapse et de neurodégénérescence dans la maladie d'Alzheimer, le ciblage de l'édition de l'ARN au site Q/R de GluA2 pourrait être une approche thérapeutique, et l’édition de l’ARN peut réguler les épines dendritiques dans les cerveaux sains et dans les maladies.
On pourrait se demander pourquoi le mécanisme décrit n'affecte pas d'autres fonctions du cerveau et aussi d'autres organes, notamment les muscles. De plus ces résultats sont obtenus à partir d'un modèle très spécifique de souris modèle de la maladie et toute étude qui prétend à des résultats extraordinairse mais qui n'est pas testée sur différents animaux modèles de la maladie n'est guère crédible. Après tout ces souris ne coutent pas très cher.

 Les lymphocytes T matures sont considérés comme immunologiquement naïfs jusqu'à ce qu'ils rencontrent le peptide spécifique dans le contexte d'une molécule d'antigène leucocytaire humain (HLA) que leur récepteur reconnaît. Une fois la reconnaissance de l’antigène effectuée, les cellules reçoivent un signal prolifératif qui conduit à une expansion marquée des lymphocytes T spécifiques de l’antigène et à une réponse inflammatoire. Bien que beaucoup de ces cellules subissent l’apoptose après la réponse initiale, d’autres sont sauvées de la rétraction immunitaire et persistent sous forme de cellules T mémoire. Les lymphocytes T mémoire peuvent répondre rapidement à une nouvelle provocation spécifique d’un antigène et persister dans la circulation à long terme
Les lymphocytes T matures sont considérés comme immunologiquement naïfs jusqu'à ce qu'ils rencontrent le peptide spécifique dans le contexte d'une molécule d'antigène leucocytaire humain (HLA) que leur récepteur reconnaît. Une fois la reconnaissance de l’antigène effectuée, les cellules reçoivent un signal prolifératif qui conduit à une expansion marquée des lymphocytes T spécifiques de l’antigène et à une réponse inflammatoire. Bien que beaucoup de ces cellules subissent l’apoptose après la réponse initiale, d’autres sont sauvées de la rétraction immunitaire et persistent sous forme de cellules T mémoire. Les lymphocytes T mémoire peuvent répondre rapidement à une nouvelle provocation spécifique d’un antigène et persister dans la circulation à long terme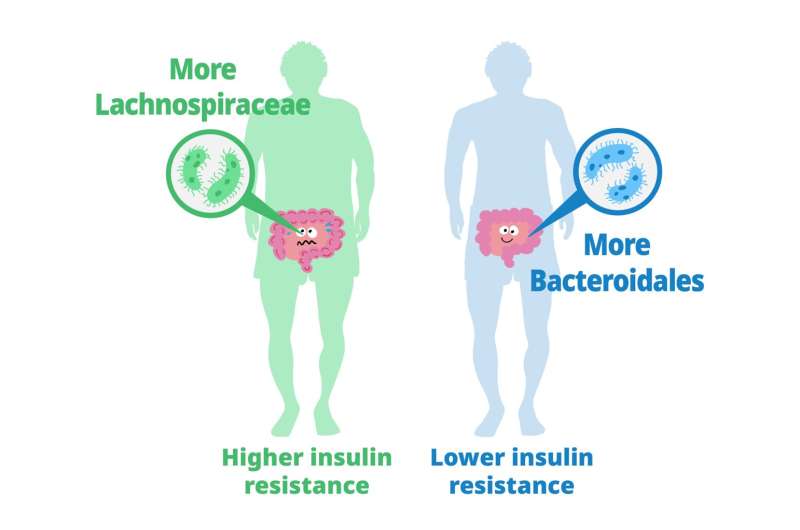 Previous studies have explored the role of gut microbiota in metabolizing nutrients in insulin resistance. This research aims to uncover the mechanisms underlying this relationship using a multi-omics approach. The study analyzes data from 306 individuals without diabetes, focusing on insulin resistance as defined by HOMA-insulin resistance scores.
Previous studies have explored the role of gut microbiota in metabolizing nutrients in insulin resistance. This research aims to uncover the mechanisms underlying this relationship using a multi-omics approach. The study analyzes data from 306 individuals without diabetes, focusing on insulin resistance as defined by HOMA-insulin resistance scores. Until now, studies on Klotho have primarily focused on its effects on animal models such as mice, rather than directly increasing its levels in primates.
Until now, studies on Klotho have primarily focused on its effects on animal models such as mice, rather than directly increasing its levels in primates. This condition affects individuals, mostly adults over the age of 50, who physically act out their dreams during sleep, resulting in injuries to themselves or their bed partners. It's also suspected to be involved in premisses of Parkinson's disease. The study, published in the Journal of Neuroscience, presents a novel model that characterizes how REM sleep behavior disorder develops due to neurodegeneration associated with the accumulation of tau protein.
This condition affects individuals, mostly adults over the age of 50, who physically act out their dreams during sleep, resulting in injuries to themselves or their bed partners. It's also suspected to be involved in premisses of Parkinson's disease. The study, published in the Journal of Neuroscience, presents a novel model that characterizes how REM sleep behavior disorder develops due to neurodegeneration associated with the accumulation of tau protein.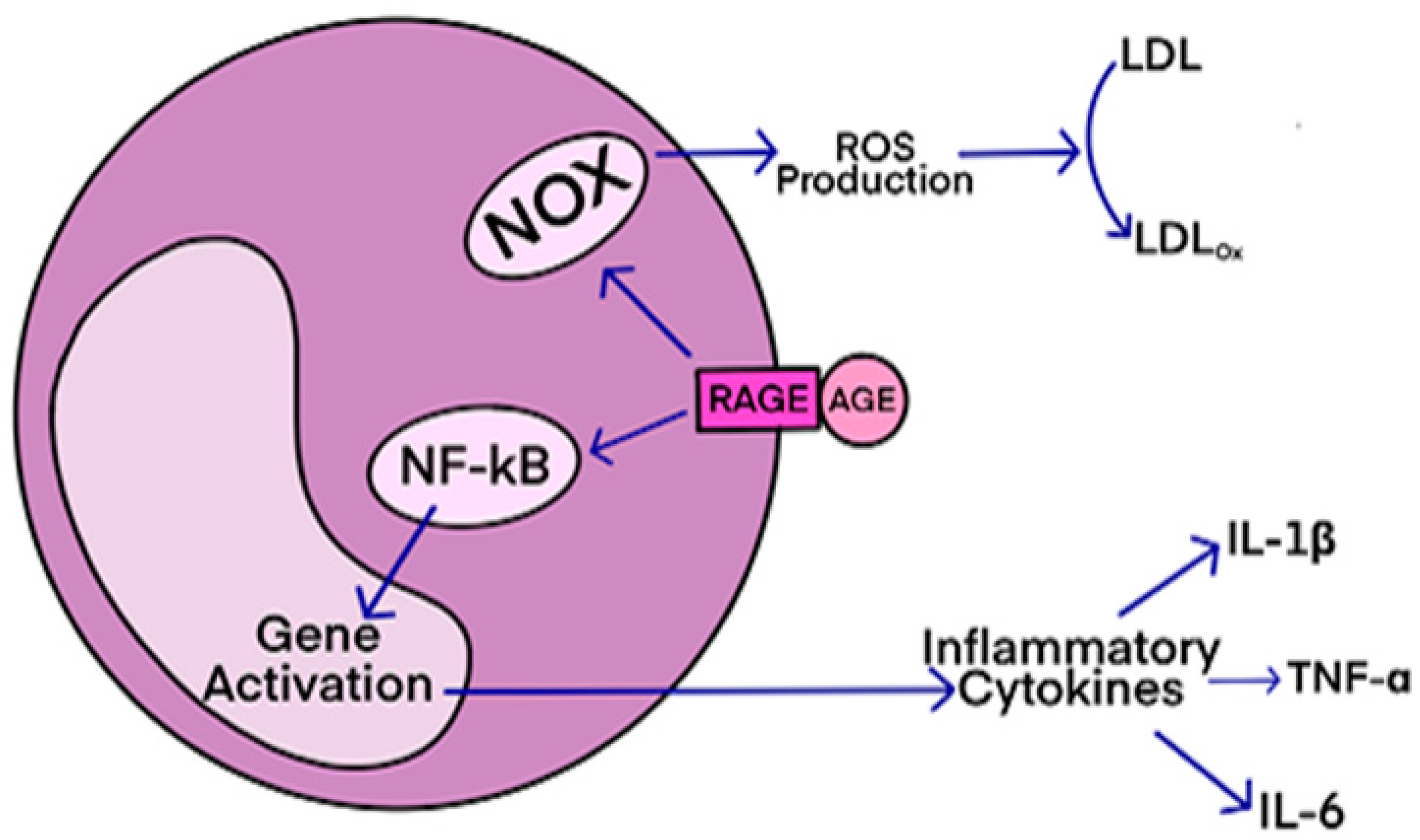 AGEs have diverse structures, but only a limited number have been characterized. Some AGEs are small molecules formed through proteolytic degradation of protein-crosslinked or protein-modified AGEs. Imbalance between the formation and destruction of AGEs, particularly under conditions of oxidative stress, results in excessive accumulation and disease progression.
AGEs have diverse structures, but only a limited number have been characterized. Some AGEs are small molecules formed through proteolytic degradation of protein-crosslinked or protein-modified AGEs. Imbalance between the formation and destruction of AGEs, particularly under conditions of oxidative stress, results in excessive accumulation and disease progression. Des études précliniques ont montré que pendant le sommeil, l'infiltration du liquide interstitiel et céphalo-rachidien le long des espaces périvasculaires augmente, augmentant ainsi la clairance des solutés interstitiels. Lorsqu'ils sont agrandis, les espaces périvasculaires sont visibles par imagerie par résonance magnétique cérébrale (IRM).
Le volume et le nombre de espaces périvasculaires augmentent avec l'âge.
Ce phénomène est associés à des facteurs de risque vasculaire tels que l'hypertension, des marqueurs de microangiopathie telle que la leucoaraiose et entraine des effets néfastes sur la santé. Une question importante est de savoir si le manque de sommeil est la cause de ces risques vasculaires, ou simplement leur conséquence.
Des études précliniques ont montré que pendant le sommeil, l'infiltration du liquide interstitiel et céphalo-rachidien le long des espaces périvasculaires augmente, augmentant ainsi la clairance des solutés interstitiels. Lorsqu'ils sont agrandis, les espaces périvasculaires sont visibles par imagerie par résonance magnétique cérébrale (IRM).
Le volume et le nombre de espaces périvasculaires augmentent avec l'âge.
Ce phénomène est associés à des facteurs de risque vasculaire tels que l'hypertension, des marqueurs de microangiopathie telle que la leucoaraiose et entraine des effets néfastes sur la santé. Une question importante est de savoir si le manque de sommeil est la cause de ces risques vasculaires, ou simplement leur conséquence.
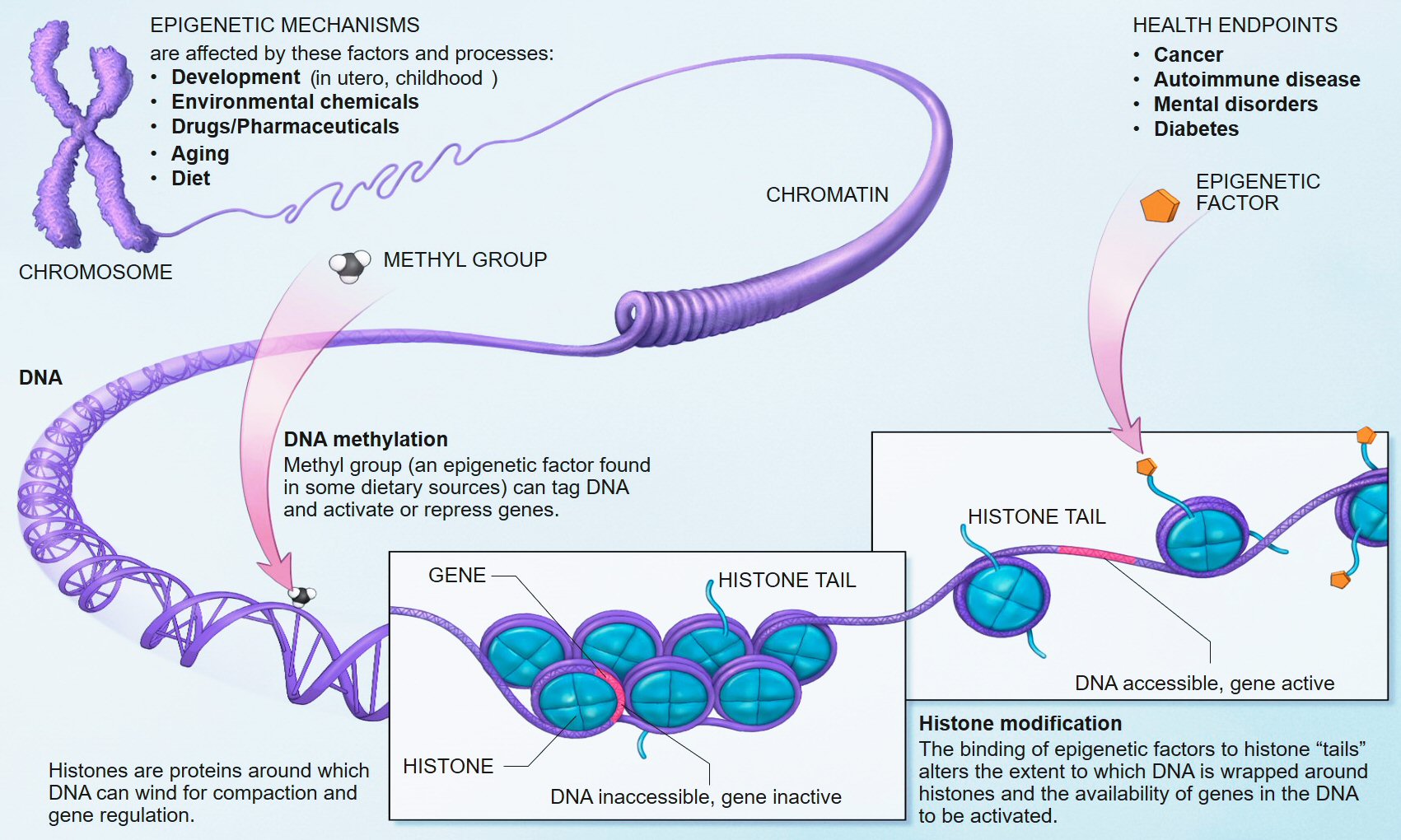 Source Wikipedia.
Source Wikipedia. While wild-type mice grew fat with age, animals lacking both copies of the epigenetic reader Baz2b stayed trim, indicating improved mitochondrial function. [Yuan et al., Nature, 2020.]
While wild-type mice grew fat with age, animals lacking both copies of the epigenetic reader Baz2b stayed trim, indicating improved mitochondrial function. [Yuan et al., Nature, 2020.]