Ce poste consiste en une traduction et adaptation d’un article en anglais très intéressant montrant les difficultés à mener un essai clinique. Il s’agit de cet article :
Introduction
La sclérose latérale amyotrophique, communément appelée maladie de Charcot en France, est une maladie neurologique grave caractérisée par la dégénérescence des motoneurones. Bien que la cause ultime du décès soit due à une insuffisance des muscles respiratoires, les manifestations cliniques sont très hétérogènes, avec une distinction anatomique entre une forme bulbaire, plus rare mais à la progression rapide et une autre forme appelée spinale ou rachidienne à la vitesse de progression plus lente.
Des études suggèrent l'implication de nombreuses voies cellulaires associées à cette maladie. Cependant, il reste difficile de déterminer si l’altération de ces mécanismes provoque la maladie ou s’il s’agit seulement de conséquences de celle-ci. Une origine génétique de la maladie est cependant à l’origine d’environ 10 % des cas de SLA dites « familiales », mais on ignore la cause de l’apparition de la maladie chez la plupart des patients (SLA sporadique) et il est possible cela soit dû à de multiples facteurs, certains biologiques, d’autres environnementaux.
Étant donné le grand nombre de voies cellulaires potentiellement impliquées dans la SLA, il n'est pas surprenant que de nombreuses études scientifiques cherchent de nouvelles thérapies contre la SLA. Cependant, malgré ces nombreux efforts la plupart des essais cliniques menés au cours des trois dernières décennies n’ont pas réussi à démontrer l’efficacité de l’une de ces thérapies dans le cas de la SLA sporadique. Actuellement, un seul médicament – le riluzole – a été approuvé par les autorités réglementaires du monde entier, et peu d'autres sont à un stade avancé de développement.
Un livre blanc a été récemment publié par un groupe international d'experts comprenant des universitaires, des industriels et des représentants de patients, pour tirer les leçons de l'expérience et faciliter la traduction de la découverte de médicaments en développement clinique. Ce document propose un cadre de principes, allant de la compréhension des bases moléculaires de la maladie à la médecine expérimentale en passant par la découverte de médicaments. La possibilité de réutilisation des médicaments fait partie de ces pistes, même si cela peut s'avérer difficile. Enfin, le manque de biomarqueurs bien validés pour soutenir la découverte et le développement de médicaments est identifié comme une lacune importante dans la SLA, entravant une évaluation rapide de l'engagement et de l'efficacité des cibles dans les études précliniques et cliniques.
Nous examinons ici une étude de cas italienne basée sur la réutilisation d'un médicament à base de guanabenz, un ancien agoniste des récepteurs adrénergiques alpha-2 approuvé par la FDA, qui a été testé dans un essai clinique de phase 2 mené chez des patients atteints de SLA.
Il s’agissait d’une étude pilote académique principalement soutenue par la Fondazione Italiana di Ricerca per la Sclerosi Laterale Amiotrofica (AriSLA), l’agence de financement italienne dédiée à la recherche sur la SLA à la suite d’un de ses appels compétitifs à projets de recherche. La conception de l'essai était basée sur 4 branches, testant 3 doses différentes de guanabenz par rapport à un placebo, avec l'efficacité et la sécurité comme critères d'évaluation. Il ne s’agissait pas encore d’une étude de phase III qui a le double but de valider l’efficacité pour une dose déterminée.
Bien que l'étude ait confirmé l’efficacité des 2 doses de traitement les plus élevées chez les patients présentant un début bulbaire, un développement clinique ultérieur n'a pas pu être poursuivi pour plusieurs raisons brièvement évoquées ci-dessous.
De la validation préclinique de cibles à un essai clinique de phase 2
Le cycle de vie d’une protéine commence par la création d’une première version dans les ribosomes à partir de l’ARN messager. Les ribosomes sont de petits vésicules « accrochés » à une structure en forme de mille feuille nommée le réticulum endoplasmique (RE). Celui-ci à pour rôle de replier les nouvelles protéines et quand cette tâche est achevée, une autre structure, l’appareil de Golgi, envoi cette protéine là où elle doit assurer son rôle fonctionnel.
Les attaques de pathogènes, l’absence de nutriment ou divers dérèglements liés à l’âge génèrent ce qu’on appelle le stress du réticulum endoplasmique (RE) et la cellule déclenche alors un mécanisme de protection appelé la réponse protéique dépliée (UPR) qui inhibe la production des protéines dans les ribosomes, en quelque sorte pour permettre un nettoyage de la chaîne de production de protéines. Il y a une certaine analogie avec une plante à qui on ne fournit plus d’eau et qui flétrit.
- Si cette période de stress dure peu de temps, le déclenchement de l'UPR permet à la cellule de revenir aux conditions physiologiques normales (si on redonne de l’eau à la plante, elle se revivifie).
- Dans des conditions de stress prolongées, d’autres mécanismes sont déclenchés, (la phosphorylation de eIF2α), ce qui provoque une réduction du flux de protéines à travers le réticulum endoplasmique. Quand les conditions normales sont revenues la cellule active un nouveau signal (PPP1R15A), qui restaure une production normale de protéines suivie d’un recyclage de celles-ci quand leur rôle est achevé. Un état de stress prolongé du réticulum endoplasmique est dangereux car cela signifie que les protéines non repliées « stationnent » à l’entrée du RE sans y être traitées et ces formes non repliées sont dangereuses (diffusion « de type prion »).
- Si les conditions de stress ne sont pas résolues, l’UPR conduit au suicide de la cellule (l’apoptose) ou à sa dégénérescence. Il a été démontré que le stress persistant contribue à la neurodégénérescence à la fois dans des modèles animaux et dans des cellules dérivées de patients atteints de SLA sporadique ou familiale.
Le rôle clé de PPP1R15A a été suggéré par des études montrant que son inactivation génétique entraînait une augmentation significative de la survie des souris SOD1G93A et SOD1G85R.
Il a été démontré que Guanabenz, un ancien agoniste des récepteurs alpha-2-adrénergiques utilisé comme médicament antihypertenseur, module la production (la trancription) de PPP1R15A et réduit l'activité du complexe eIF2α phosphatase. Cette réduction entraîne une réduction de la surcharge des ER à la fois dans les cultures cellulaires in vitro et dans les études in vivo sur des animaux modèles de la SLA.
Guanabenz module également le repliement des ribosomes, réduisant ainsi la propagation de type prion dans les animaux modèles de type levure, de drosophile et de souris.
L’ensemble de ces éléments in vitro et in vivo suggère que la voie UPR pourrait constituer une cible thérapeutique potentielle pour la SLA et fournissent une justification solide pour envisager la réutilisation du guanabenz dans la SLA.
L’essai « ProMISe »
Un essai de phase II dans plusieurs centres hospitaliers (multicentrique), randomisé, en double aveugle, a alors été conçu et développé afin de tester l'efficacité et l'innocuité du guanabenz chez des patients atteints de SLA. La conception de l'étude était basée sur 4 branches (rapport 1:1:1:1), avec 3 doses différentes de guanabenz : 16, 32, 64 mg deux fois par jour plus 100 mg de riluzole par jour versus 100 mg de riluzole par jour seul (placebo). La branche placebo était uniquement destinée à comparer l’innocuité et la tolérabilité.
L’étude était basée sur une méthode statistique nommée « hypothèse nulle ». Dans cette méthode on cherche à savoir si une hypothèse d’un effet bénéfique du médicament est crédible du point de vue statistique. On dit que l’hypothèse d’un effet bénéfique est futile, si on n’arrive pas à démontrer cet effet.
L'hypothèse nulle de l'étude était que le guanabenz réduirait d'au moins 35 % la proportion de patients ayant progressé vers un stade supérieur de la maladie à 6 mois par rapport à leur valeur de départ et par rapport à une cohorte historique de 200 patients italiens. En effet dans un contexte où il n’existe aucun médicament efficace pour ralentir la progression de la maladie dans le cas de la SLA sporadique, un médicament qui permettrait de ralentir cette progression pour un malade sur trois, serait un progrès considérable. La formulation indique aussi à ce que les concepteurs s’attendaient à avoir des sous-populations différentes parmi les malades, ce qui est une conception assez concensuelle parmi les chercheurs.
Au total, 201 patients répondant aux critères d'inclusion ont été répartis au hasard (randomisation) entre les différentes branches de l’essai clinique.
L'étude a été coordonnée par l'Institut neurologique « Carlo Besta » de la Fondation IRCCS, à Milan, en Italie, et a impliqué 22 sites d'essai à travers l'Italie pour atteindre le nombre de patients requis par le calcul de la taille de l'échantillon. En effet le nombre de malades de la SLA à un instant donné est relativement faible, pas tant à cause de la relative rareté de la maladie, qu’à cause de la faible espérance de vie.
Ce grand nombre de sites impliquait plusieurs problèmes de gestion :
(i) l'approbation par tous les comités d'éthique locaux prenait beaucoup de temps, prolongeant la période de randomisation et la durée globale de l'étude ;
(ii) cela nécessitait une formation entre les centres pour assurer l'harmonisation des mesures et des procédures de résultats ;
(iii) cela nécessitait de solides activités de coordination et de suivi. En effet il faut que les emballages ne puissent révéler si l’on administre le médicament ou son placebo. Il faut relancer chaque site qui est en retard dans la production d’information, etc.
Cependant, une étude universitaire financée par un petit organisme de bienfaisance a révélé que le financement prévu était insuffisant pour couvrir tous les besoins de gestion d'un essai multicentrique d'une telle envergure.
Mais les plus gros obstacles venaient du médicament lui-même. Alors que l'essai était en préparation, le guanabenz venait d’être retiré du marché. L’investigateur principal (le chef de projet) a réussi à trouver une entreprise pour fabriquer – et faire don – du médicament expérimental et du placebo, sachant dès le départ que, même si le résultat était positif, le médicament ne serait pas disponible pour un développement clinique ultérieur.
Au cours de l'essai, l'effet antihypertenseur alpha-2 adrénergique du médicament a occasionné des taux d'abandon élevés parmi les malades des deux branches à dose élevée. Cependant, l'hypothèse de non-futilité de l'essai a malgré tout été retenue pour les deux groupes à dose plus élevée, avec une proportion significativement plus faible de patients ayant progressé vers un stade plus avancé de la maladie que dans le groupe recevant la dose la plus faible ou le placebo et les données historiques. Les données historiques sont importantes car mesurer la progression de la SLA est difficile et les instruments (des questionnaires) peu fiables. De plus les petits échantillons de malades sont statistiquement susceptibles de présenter des valeurs anormales.
Cette différence était particulièrement celle des patients présentant une forme bulbaire (aucun d'entre eux dans ces deux groupes n'a progressé vers un stade supérieur de la maladie au cours des 6 mois de traitement, contre 50 % dans le groupe à dose la plus faible, et 36 % dans le groupe placebo). Il est possible que sans le facteur de confusion qu'est la mauvaise tolérance du médicament, la différence entre les groupes à apparition spinale et bulbaire aurait pu être encore plus prononcée.
Des résultats innovants
Bien que la poursuite du développement clinique du guanabenz n'ait pas été possible en raison de l'indisponibilité du médicament et, plus important encore, de la mauvaise tolérance des doses efficaces chez une population de patients ne souffrant pas d'hypertension, l'essai ProMISe a fourni des informations pertinentes qui ont ouvert la voie à de nouvelles innovations thérapeutiques pour la SLA. L’une de celles-ci est la conception de Sephin1, un dérivé du guanabenz sans le composant hypotenseur. Cette molécule, rebaptisée IFB-088 (icerguastat) d’InFlectis BioScience, avait déjà fait l'objet d'un essai de phase I chez des volontaires sains et un essai de phase II multicentrique et multinational a été lancé, qui est en cours en Italie et en France avec l'Institut Carlo Besta de Milan coordonnant les sites d'essais italiens (protocole TRIALS) et dont les résultats sont attendus en fin 2024.
L'Icerguastat a reçu la désignation de médicament orphelin pour le traitement de la SLA par la FDA et l'EMA (respectivement agences US et Européenne du médicament). En inhibant l'activité du complexe phosphatase PPP1R15A, il assure la ré-initiation de la traduction des protéines par les ribosomes, de ce fait les cellules sortent du mécanisme de réponse au stress et redeviennent fonctionnelles.
Basée sur les enseignements tirés de l'essai sur le guanabenz, la nouvelle étude a inclus uniquement des patients SLA à début bulbaire.
L'étude ProMISe a également analysé les différences potentielles dans les niveaux de biomarqueurs entre les branches, sans trouver de changements significatifs dans le composant neurofilament. Mais, l’évaluation des niveaux de transcription des miARN, a mis en évidence les différences entre les patients SLA présentant un début bulbaire et un début rachidien. Les miARN sont des régulateurs post-transcriptionnels capables d’inhiber la traduction d’un gène en une protéine. Il y a donc un lien clair entre le médicament Guanabenz et l’évolution de ce marqueur biologique chez les patients de type bulbaire.
Cela a conduit à un nouveau projet de recherche, sélectionné pour financement par l’appel compétitif AriSLA, qui étudiera les différences entre les miARN dans les échantillons biologiques, y compris ceux collectés dans le cadre de l’étude ProMISe. Des analyses moléculaires sophistiquées seront utilisées pour comparer les deux groupes de patients entre eux et avec des échantillons provenant d'individus sains.
Discussion
De nombreuses publications soulignent l’importance stratégique de la réutilisation des médicaments dans le traitement des maladies rares. Il est toutefois relativement rare que des médicaments réutilisés soient approuvés à la demande de l’industrie. En conséquence, le développement clinique utilisant cette approche est plus fréquemment tenté par des universitaires, souvent en collaboration avec des organisations à but non lucratif. Cependant de nombreux obstacles au développement clinique subsistent.
Nous avons présenté ci-dessus l'exemple de l'essai ProMISe, une étude académique financée par AriSLA, une fondation à but non lucratif s'intéressant spécifiquement à la SLA, pour illustrer certains des obstacles rencontrés et commenter les facteurs clés de succès qui ont contribué à l'essai clinique. Parmi les obstacles, il est importance de disposer de ressources financières suffisantes.
Certains aspects clés qui ont contribué au succès et à la valeur informative de l'essai ProMISe ont été identifiés :
i) La justification de la cible moléculaire était suffisamment robuste et validée indépendamment par différents groupes dans plusieurs modèles cellulaires et animaux.
ii) La conception de l'étude doit être adaptée à l'hypothèse à démontrer.
iii) Les critères de réussite de l’essai clinique doivent être soigneusement considérés.
iv) L'essai clinique doit être considéré comme faisant partie du processus de développement de la thérapie.
Sur ce dernier point, un obstacle majeur est, en général, représenté par le fait que les universitaires n'ont pas l'expertise, ni l'intérêt ou le statut juridique, pour devenir eux-mêmes titulaires d'une autorisation de mise sur le marché. Très souvent, les chercheurs se concentrent sur la validation clinique d’une cible moléculaire identifiée pour fournir une preuve de concept d’efficacité, plus par curiosité que par conscience du long processus nécessaire pour mettre le médicament sur le marché. Dans tous les cas, ils devront collaborer avec un partenaire industriel pour assurer l’approvisionnement et la commercialisation.
La démonstration de l’effet du guanabenz dans la SLA à apparition bulbaire a donné lieu à un modèle d’essai clinique innovant impliquant uniquement des patients présentant ce phénotype spécifique. Au sein de l’énorme hétérogénéité de la SLA, dont les multiples phénotypes ont une espérance de vie variant de 1 à plus de 10 ans après l’apparition de la maladie, la SLA de type bulbaire est le phénotype le plus homogène, aussi bien en termes de progression que par les symptomes.
Elle représente environ 30 % de tous les patients, bien que plus fréquente chez les patients présentant une expansion répétée de l'hexanucléotide C9orf72, l'apparition bulbaire n'est pas corrélée à un génotype spécifique.
Au cours des 30 dernières années, le concept de la SLA en tant que maladie unique (au contraire de la SLA comme un terme parapluie pour des maladies différentes) a motivé la conception d’essai clinique, dont la quasi-totalité ont échoué. Ce concept de maladie unique implique que n'importe quel patient, quels que soient ses symptômes et l’évolution de sa maladie, aurait la même réponse à un médicament. L'étude ProMISe a suggéré que ce n'était peut-être pas le cas, comme le prévoyait l'essai sur le riluzole montrant une amélioration médiane de la survie de 2,8 fois chez les patients à début bulbaire, mais aucun avantage chez les patients à forme spinale.
L'innovation et la génération de nouvelles connaissances sont des facteurs importants pour faciliter la participation d'un partenaire industriel. L'étude ProMISe a montré qu'il n'était pas possible de réutiliser le guanabenz pour la SLA en raison de sa tolérabilité limitée et de son retrait du marché. Cependant, les informations obtenues ont aidé une entreprise, Inflectis Bioscience, à s'engager dans une nouvelle voie de développement avec une molécule dérivée sans les effets indésirables du guanabenz et ont fourni des orientations importantes pour la conception d'un nouvel essai axé sur les patients à apparition bulbaire. La nouvelle étude doit confirmer si la plus grande spécificité cible du nouveau composé est suffisante pour reproduire les effets positifs observés avec le guanabenz.
Depuis 2018, AriSLA n'admet plus d’essais cliniques dans ses appels à proposition annuels, car les coûts de ces études ne sont pas supportables pour la Fondation, alors que ses appels sont ouverts à la recherche fondamentale/préclinique et aux études cliniques observationnelles. Inspiré par le plan stratégique pour la SLA publié par le National Institutes of Health des États-Unis, AriSLA cherche maintenant à comprendre l'hétérogénéité de la SLA chez l'homme. ainsi que dans les modèles précliniques.
Conclusion
L’essai ProMISe a été un succès non seulement parce qu’il a confirmé l’intérêt du guanabenz dans la SLA bulbaire, mais aussi grâce aux connaissances qu’il a générées sur la maladie. Même si la réutilisation du guanabenz n’a pas pu être poursuivie, l’étude a ouvert des voies innovantes qui sont actuellement en cours de développement clinique dans la SLA.
Cela doit être considéré comme un message important pour encourager les universitaires à saisir toutes les opportunités d'explorer la réutilisation de médicaments dans les maladies rares, à condition que la justification préclinique soit suffisamment solide, que la conception de l'étude soit adaptée pour répondre de manière adéquate à l'hypothèse sous-jacente et soit informative, et qu'elle soit intégrée dans une perspective à long terme de développement de médicament.

 De façon similaire, la force des souris modifiés génétiquement est nettement plus basse au début du traitement qu’à la fin, c’est l’inverse de ce qu’on pourrait attendre d’une souris qui serait de plus en plus affaiblie.
Et pourquoi ce groupe de souris aurait-il une force plus faible au début de l’expérience ? S’il n’y a pas de sélection à priori, les différents groupes de souris (traités et non traités) devraient avoir la même force.
De façon similaire, la force des souris modifiés génétiquement est nettement plus basse au début du traitement qu’à la fin, c’est l’inverse de ce qu’on pourrait attendre d’une souris qui serait de plus en plus affaiblie.
Et pourquoi ce groupe de souris aurait-il une force plus faible au début de l’expérience ? S’il n’y a pas de sélection à priori, les différents groupes de souris (traités et non traités) devraient avoir la même force. Ils ont confirmé qu'une exposition prolongée aux NRTI était associée à un risque moindre de développer la maladie d’Alzheimer.
- D’après les données du VA, chaque année supplémentaire de traitement par NRTI était associée à une réduction de 4 à 6 % du risque de maladie d’Alzheimer.
- D’après les données de MarketScan, la réduction était encore plus marquée : de 10 à 13 % par année d’utilisation.
Ils ont confirmé qu'une exposition prolongée aux NRTI était associée à un risque moindre de développer la maladie d’Alzheimer.
- D’après les données du VA, chaque année supplémentaire de traitement par NRTI était associée à une réduction de 4 à 6 % du risque de maladie d’Alzheimer.
- D’après les données de MarketScan, la réduction était encore plus marquée : de 10 à 13 % par année d’utilisation.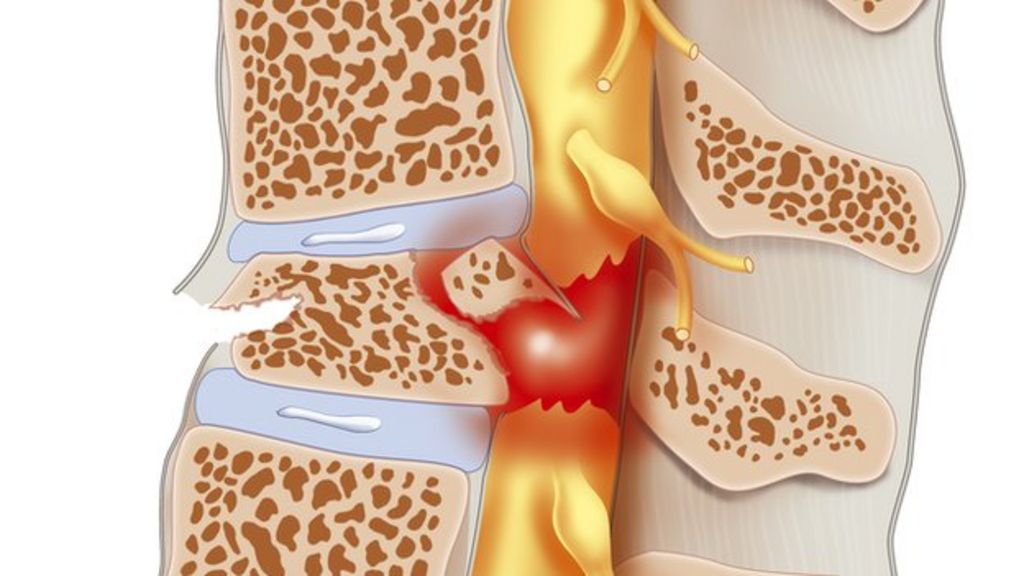 Si dans la SLA/Maladie de Charcot les neurones moteurs meurent (ce dont je ne suis pas sûr
Si dans la SLA/Maladie de Charcot les neurones moteurs meurent (ce dont je ne suis pas sûr  C’est un progrès conséquent de l’état de l’art. Par contre ce neurone moteur ne s’est pas connecté via des synapses à d’autres cellules comme d’autres neurones moteurs, des interneurones ou des cellules de fibres musculaires. Il ne s’agit que d’un seul neurone, très court, pas des milliers de neurones moteurs long jusqu'à un mètre, qui composent la moelle spinale. De plus des neurones qui ne seraient pas accompagnés par une multitude de cellules non-neuronales (astrocytes, oligodendrocytes, etc..), mourraient rapidement. Enfin dans la moelle spinale il n’y a pas que des neurones moteurs.
C’est un progrès conséquent de l’état de l’art. Par contre ce neurone moteur ne s’est pas connecté via des synapses à d’autres cellules comme d’autres neurones moteurs, des interneurones ou des cellules de fibres musculaires. Il ne s’agit que d’un seul neurone, très court, pas des milliers de neurones moteurs long jusqu'à un mètre, qui composent la moelle spinale. De plus des neurones qui ne seraient pas accompagnés par une multitude de cellules non-neuronales (astrocytes, oligodendrocytes, etc..), mourraient rapidement. Enfin dans la moelle spinale il n’y a pas que des neurones moteurs. Ces cellules, contrairement aux neurones, ressemblent plus à leurs consoeurs du reste du corps à la fois par la morphologie et la durée de vie. A l'inverse un neurone est caractérisé par un ou plusieurs appendices dendritiques et axonaux et ne se reproduisent pas. Les neurones ont besoin des astrocytes et de nombreux autres types de cellules pour survivre.
Ces cellules, contrairement aux neurones, ressemblent plus à leurs consoeurs du reste du corps à la fois par la morphologie et la durée de vie. A l'inverse un neurone est caractérisé par un ou plusieurs appendices dendritiques et axonaux et ne se reproduisent pas. Les neurones ont besoin des astrocytes et de nombreux autres types de cellules pour survivre. Il y a aussi quelque chose de fondamentalement contre-intuitif, voire obscène, dans l'idée que pour ralentir la progression d'une maladie caractérisée principalement par la perte intense de masse musculaire, il faudrait faire davantage d’exercice physique. Pourtant on sait que chez des sujets sains l'absence de mouvement pendant quelques jours à la suite d'un alitement, fait fondre spectaculairement la masse musculaire et qu'il faut des semaines pour retrouver le niveau antérieur de masse musculaire.
Il y a aussi quelque chose de fondamentalement contre-intuitif, voire obscène, dans l'idée que pour ralentir la progression d'une maladie caractérisée principalement par la perte intense de masse musculaire, il faudrait faire davantage d’exercice physique. Pourtant on sait que chez des sujets sains l'absence de mouvement pendant quelques jours à la suite d'un alitement, fait fondre spectaculairement la masse musculaire et qu'il faut des semaines pour retrouver le niveau antérieur de masse musculaire.