Qu'est ce que la maladie de Parkinson?
La maladie de Parkinson est le deuxième trouble neurodégénératif progressif le plus fréquent et se caractérise par une perte sélective de neurones dopaminergiques dans la substantia nigra pars compacta, qui provoque des dysfonctionnements moteurs tel que l'hypertonie (cocontraction musculaire agoniste-antagoniste), tremblement au repos, et rigidité (akinésie).
À ce jour, il n'y a aucune thérapie neuroprotectrice qui pourrait traiter cette maladie ou simplement arrêter sa progression. Bien que la dopamine soulage le dysfonctionnement symptomatique moteur, son efficacité est réduite au fur et à mesure que la maladie progresse, ce qui mène à des effets secondaires tels que les fluctuations motrices graves et la dyskinésie. De plus, cette approche thérapeutique palliative ne traite pas des mécanismes sous-jacents de la maladie.
Lien entre les intestins et le cerveau
De nombreux éléments indiquent une possible connection entre l’intestin et la maladie de Parkinson. Une nouvelle étude de l’École de médecine de l’Université Johns Hopkins a ajouté du poids à ces éléments et présente une nouvelle approche thérapeutique pour tester les médicaments visant à traiter la maladie de Parkinson.
Dans des études sur des souris, les scientifiques de Johns Hopkins ont constaté que la protéine d’alpha-synucléine mal repliée, qui, selon les scientifiques, s’accumule dans le cerveau et conduit la maladie de Parkinson, peut voyager de l’intestin au cerveau. Ces scientifiques ont publié leur résultats dans la revue Neuron.
En 2003, le neuroanatomiste allemand Heiko Braak et ses collègues ont découvert que dans des échantillons post mortem de patients atteints de la maladie de Parkinson, des amas d’alpha-synucléine apparaissaient également dans le système nerveux qui contrôle l’intestin, connu sous le nom de système nerveux entérique. Cela avait du sens pour Braak et ses collègues, parce que les patients atteints de la maladie de Parkinson développent souvent des troubles gastro-intestinaux tels que la constipation bien avant qu’ils ne présentent les déficiences motrices qui sont caractéristiques de la maladie de Parkinson. On estime, par exemple, que deux patients sur trois, souffrent de constipation sévère. Braak a donc émis l’hypothèse que la maladie de Parkinson pourrait provenir de l’intestin. Pour Braak, le cerveau est envahi via les nerfs olfactifs et le nerf vague (nerf cranial X), dont les fibres parasympathiques innervent l’intestin, par des métabolites et même peut-être par des virus.
Des confirmations par d'autres équipes
En utilisant des rats et en injectant dans leur intestin cette protéine sous sa forme « toxique » isolée de cerveaux de malades morts à la suite de la maladie de Parkinson, l’équipe de l’Université de Lund avait ensuite confirmé la proposition de Braak, dans une étude publiée en 2014 dans la revue Acta Neuropathologica.
L’automne dernier, une équipe de scientifiques dirigée par l’Institut de recherche Van Andel a constaté que les personnes dont les appendices sont enlevés tôt dans la vie sont également moins susceptibles de développer la maladie de Parkinson. Ils ont également découvert des amas d’alpha-synuclein dans le tissu d’appendice qu’ils ont examiné.
Mais ces dépôts d’alpha-synucléine dans le système nerveux entérique sont-ils les mêmes que ceux trouvés dans le cerveau? En d’autres termes, les agrégats voyagent-ils réellement ? Pour répondre à cette question, Ted Dawson, neurologue à Johns Hopkins, et ses collègues ont injecté de l’alpha-synucléine synthétique mal pliée dans les entrailles de souris en bonne santé.
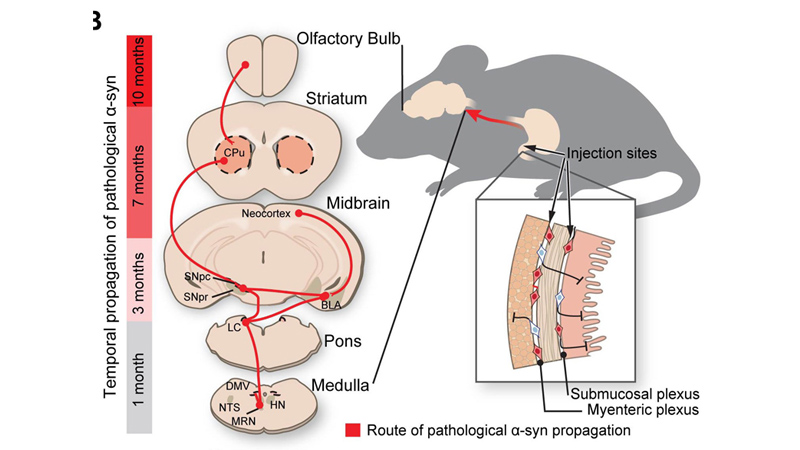
L’équipe de Dawson a testé les tissus cérébraux des animaux à un, trois, sept et dix mois après l’injection et a constaté que la protéine avait commencé à s'accumuler près du nerf vague, qui relie les principaux organes avec le cerveau, à l’intestin et a continué à se propager au cerveau.
L'expérience effectuée sur trois groupes de souris
Les chercheurs se sont alors demandé si la protéine alpha-synuclein mal pliée pouvait voyager le long du faisceau de nerf connu sous le nom de nerf vague.
Pour tester cela, les chercheurs ont injecté 25 microgrammes d’alpha-synucléine synthétique mal pliée, dans les entrailles de dizaines de souris en bonne santé. Les chercheurs ont ensuite échantillonné et analysé le tissu cérébral de ces souris à un, trois, sept et dix mois après l’injection. Au cours de l’expérience qui a duré 10 mois, les chercheurs ont obtenus des éléments confirmants que l’alpha-synucléine a commencé à s'accumuler là où le nerf vague se connecte à l’intestin et s’est ensuite propagée jusqu'au cerveau.
Les chercheurs ont ensuite mené une expérience similaire, mais ont cette fois chirurgicalement coupé le nerf vague dans un groupe de souris et injecté dans leurs intestins de l’alpha-synucléine mal plié. À l’examen à sept mois, les chercheurs ont constaté que les souris avec les nerfs de vagus coupés n’ont montré aucun des signes de mort cellulaire, qui ont été trouvés dans les souris avec les nerfs vague intacts. Le nerf sectionné semblait stopper les progrès de la protéine mal repliée.
Confirmation comportementale de la biologie moléculaire
Les chercheurs ont ensuite cherché à savoir si ces différences physiques dans la progression de la maladie de Parkinson ont entraîné des changements de comportement. Pour ce faire, ils ont évalué le comportement de trois groupes :
- Les souris injectées avec l’alpha-synucléine mal pliée,
- les souris injectées avec l’alpha-synucléine mal pliée avec les nerfs de vagus coupés,
- et les souris de contrôle sans injection et avec des nerfs de vagus intacts.
Les chercheurs ont ensuite fait endurer à ces différentes souris, les tâches qu’ils utilisaient couramment pour distinguer les signes de la maladie de Parkinson de la souris, y compris la construction de nids et l’exploration de nouveaux environnements.
Les souris avec l’alpha-synucléine mal repliée et les nerfs vagues intacts ont employé beaucoup moins de matériaux de nidification que les souris témoins et celles avec les nerfs vagues coupés, et leurs nids étaient plus petits et moins bien construits, d'après l’équipe. Le contrôle moteur des animaux s’est détérioré au fur et à mesure que la maladie progressait, exactement comme lors du cours de la maladie de Parkinson chez les humains, a déclaré Han Seok Ko, un co-auteur de l’étude.
Quel suite sera donné à ce type d'étude
Bien sûr ces découvertes ne déboucheront pas dans l'immédiat sur un médicament, de plus il y a encore plein de zones d'ombres et la biologie est quelque chose de très compliqué. Toute intervention sur un chemin biologique d'un être vivant a des implications sur de multiples fonctions.
Dawson espère que la dernière découverte de son équipe pourrait offrir un modèle pour étudier la progression de Parkinson. Les chercheurs envisagent maintenant d’explorer quelles parties du nerf vague permettent à la protéine mal repliée de s'acheminer au cerveau et ils vont étudier les mécanismes potentiels pour arrêter sa propagation.
Le rôle possible de l’intestin dans les troubles neurologiques est à la base de plusieurs startups biotechnologiques. Il s’agit notamment de Axial Biotherapeutics, qui a récemment levé 25 millions de dollars pour financer ses programmes qui ciblent le microbiome intestinal pour traiter la maladie de Parkinson et l’autisme. Kallyope, basée à New York, pense également investiguer l’axe intestin-cerveau pour trouver de petites molécules pour les maladies métaboliques et neurologiques.

