Le contrôle normal de la sécrétion d'insuline et de glucagon par les îlots pancréatiques est essentiel au maintien de l'homéostasie de la glycémie et devient défectueux pour toutes les formes de diabète sucré. Il y a des relations mal comprises entre la SLA et le diabète, tout comme il y en a entre la SLA et le cancer. Nous savons depuis longtemps qu'environ la moitié des malades atteints de SLA sont insulino-résistants. C'est aussi le cas dans d'autres maladies neuro-dégénératives comme Alzheimer ou la maladie de Kennedy. Un article récent implique un neuro-transmetteur dans la régulation de l'insuline.
Le rôle du neurotransmetteur inhibiteur GABA (acide γ-aminobutyrique) dans le contrôle de la sécrétion de cellules d'îlots pancréatiques est connu depuis longtemps. Le GABA soit libéré dans les cellules β pancréatiques à la fois par des microvésicules de type synaptique et par de grandes vésicules centrales denses sous le contrôle du glucose, et l'acide aminé sécrété empêche ensuite la libération de glucagon par les cellules α4.
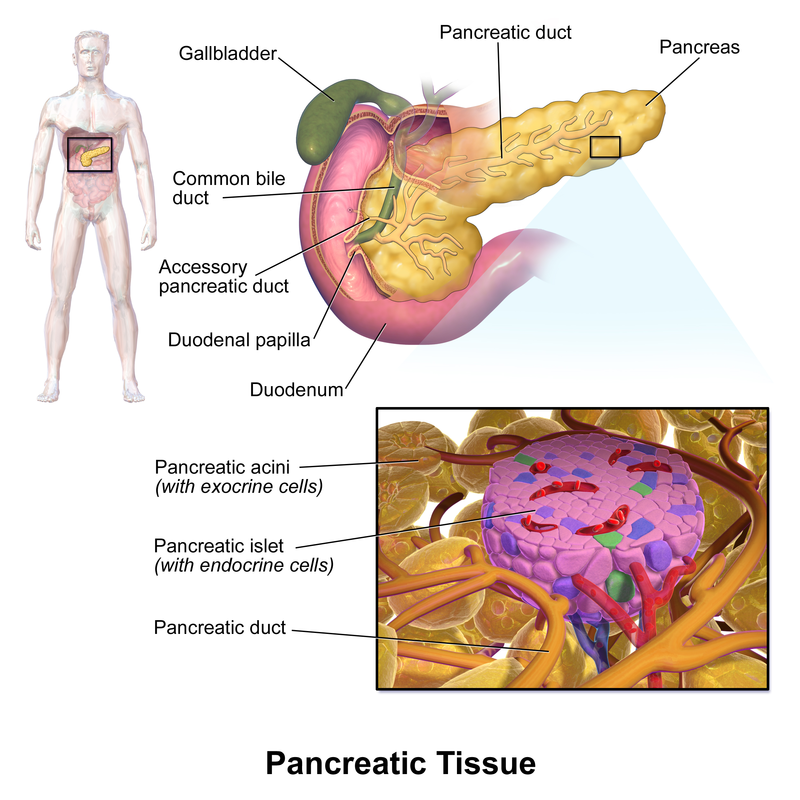 Source: Blausen.com staff (2014). "Medical gallery
Source: Blausen.com staff (2014). "Medical gallery
En agissant en tant que messager autocrine et en se liant à ses récepteurs sur les cellules β, le GABA peut également freiner la sécrétion d'insuline. Cependant il n'était pas compris, comment le neurotransmetteur pouvait entrer ou sortir de la cellule à travers la membrane plasmique. Menegaz et ses collaborateurs montrent dans leur article, que le GABA est principalement présent dans îlots humains dans le cytosol des cellules β et δ, mais non des cellules α. En outre, les auteurs ont constaté une diminution des taux de GABA dans des échantillons de patients atteints de diabète de type 1 ou de type 2, contribuant ainsi potentiellement à la libération exagérée de glucagon observée dans ces maladies. Bien que cela n'ait pas été signalé dans cette étude, les patients atteints de SLA ont des taux de GABA dans le cortex moteur nettement inférieurs à ceux des personnes en bonne santé.
Un aspect important de la nouvelle étude réside dans l’identification de médiateurs moléculaires probables de l’absorption et de la libération de GABA par les cellules β. En recherchant dans des bases de données publiées des protéines connues transportant le GABA, les auteurs ont montré que TauT était à la fois exprimé de manière détectable et localisé à la membrane plasmique dans les cellules β humaines. Un autre transporteur, le membre de la famille Slc LAT2, a également été impliqué en tant que transporteur d’un mimétique du GABA.
Les auteurs ont ensuite exploré le rôle potentiel du GABA intra-îlot dans le contrôle de la sécrétion d’hormones, montrant ainsi qu'une diminution de la synthèse de GABA par des cellules β, augmente la sécrétion d'insuline. À l'inverse, le GABA ajouté de manière exogène diminue la sécrétion d'insuline dans les cellules β stimulées par le glucose.
De manière transitoire, les travaux suggèrent un nouveau potentiel thérapeutique pour le traitement du GABA dans le diabète. Dans le diabète de type 2, les agonistes (ou les inhibiteurs du métabolisme du GABA) peuvent moduler la sécrétion d'insuline. Cependant, dans le diabète de type 1, dans lequel les cellules β ont été détruites, les antagonistes du GABA pourraient stimuler la sécrétion de glucagon et améliorer le risque d'hypoglycémie mettant la vie en danger.

