Des troubles métaboliques sont associés à la progression de la sclérose latérale amyotrophique. Cette nouvelle étude de Tanya S McDonald et de ses collègues de l'Université du Queensland est très intéressante, car elle est centrée sur la physiologie et non des phénomènes moléculaires. Tout au long de la progression de la maladie de la SLA chez des souris de laboratoire, les chercheurs ont identifié une augmentation de l'absorption du glucose, probablement due à des mécanismes indépendants de l'insuline. Ce glucose était alors stocké sous forme de glycogène dans des tissus tels que le foie, plutôt que d'être utilisée comme source d'énergie.
Normalement, chez un humain en bonne santé, l'état après repas, ou postprandial, élève les niveaux de glucose et déclenche la libération d'insuline par le pancréas. À mesure que les niveaux d'insuline augmentent, il y a une augmentation de l'absorption du glucose, de l'oxydation et du stockage dans les tissus périphériques ainsi que des augmentations dans d'autres voies anaboliques.
Le glycogène fonctionne comme l'une des deux formes de stockage d'énergie, le glycogène étant un stockage à court terme et l'autre forme étant des réserves de triglycérides dans le tissu adipeux (c'est-à-dire la graisse corporelle) pour un stockage à long terme.
Les patients atteints de SLA ne peuvent maintenir leur poids, et éprouvent une perte musculaire rapide. Curieusement cette perte musculaire ne fait pas l’objet de beaucoup d’attention de la part des scientifiques qui ne s’intéressant qu’aux neurones moteurs, déplorent un manque de biomarqueurs, alors que la perte de masse musculaire est un biomarqueur évident. Cet article tend à dire que la SLA est une forme de diabète, même si cela n’est pas exprimé formellement dans l’article.
Une perte de poids rapide chez les patients atteints de la SLA est associée à une rapide progression de la maladie, tandis qu'à l'inverse, un indice de masse corporelle plus élevé (~27) a tendance à augmenter le taux de survie. Les études suggèrent également que la résistance à l'insuline joue un rôle dans la progression de la maladie chez les patients et les modèles animaux de la SLA.
L'homéostasie du glucose est fondamentale pour le corps humain et régulée principalement par les niveaux de 4 hormones majeures : 1. L'insuline 2. Glucagon 3. Cortisol 4. Épinéphrine Les rapports de ces hormones en circulation dicteront l'activité de voies métaboliques spécifiques qui contrôlent l'homéostasie du glucose. Il existe de nombreuses autres hormones (hormone thyroïdienne, hormone de croissance, etc.) et adipokines (adiponectine, leptine, etc.) qui peuvent influencer l'homéostasie du glucose, ainsi que des mécanismes neuronaux qui contrôlent les fonctions de niveau supérieur telles que la faim et la satiété.
La sécrétion d'insuline dépend du métabolisme oxydatif. Chez l'homme, le glycogène est fabriqué et stocké principalement dans les cellules du foie et des muscles squelettiques.
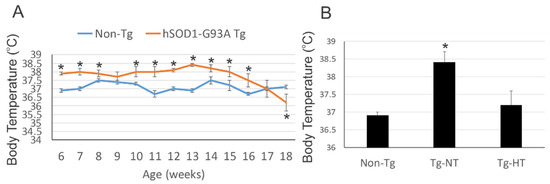
Les souris SOD1G93A présentent une perte de poids corporel et de masse corporelle maigre avec une activité réduite et augmentation de la consommation d'oxygène au stade mi-symptomatique de la maladie.
McDonald et ses collègues ont d'abord cherché à déterminer si la perte de poids fréquemment observée chez les souris SOD1G93A était plutôt due à une réduction de la prise alimentaire ou encore à une augmentation de la dépense énergétique.
Au début de la maladie, les souris n'ont montré aucune différence de poids corporel, mais avaient cependant une perte de 10 % de leur masse corporelle maigre (masse corporelle autre que la graisse, y compris les os, les muscles, le sang, la peau, etc.). C’est-à-dire que de la graisse c’était substituée à la masse musculaire. Au stade mi-symptomatique, les souris SOD1G93A pesaient significativement moins que leurs congénères normales, avec respectivement une perte de 8 et 10 % du poids corporel total et de la masse corporelle maigre.
Cependant l'apport alimentaire total était similaire entre les souris normales et les souris SOD1G93A à ces deux stades de la maladie.
Alors qu’au stade initial, il n'y avait aucune différence dans la consommation d'oxygène entre les souris mutées et normales, au stade symptomatique moyen, la consommation moyenne d'oxygène chez les souris SOD1G93A était nettement supérieure à celle des souris normales.
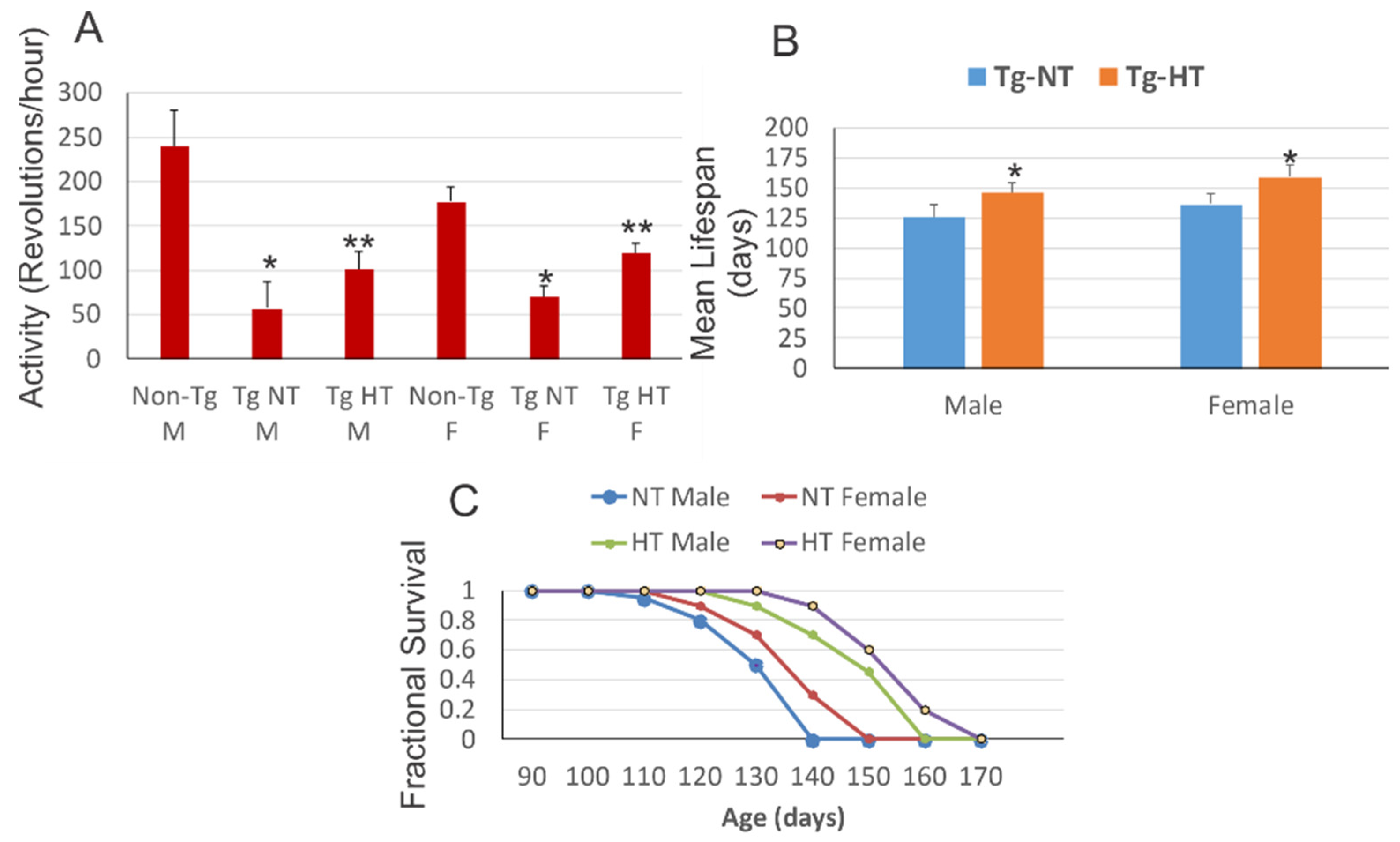
Cette augmentation de la consommation d'oxygène au stade mi-symptomatique n'était pourtant pas due à une augmentation de l'activité locomotrice moyenne, car la réduction de l'activité locomotrice a été mesurée que pendant le cycle d'obscurité aux stades d'apparition et mi-symptomatique. En effet, pendant la phase lumineuse, les souris SOD1G93A à mi-symptômes étaient 126 % plus actives que leurs congénères normales.
Aucune corrélation n'a été trouvée entre la diminution de la masse corporelle maigre et la consommation moyenne d'oxygène sur une période de 24 heures.
L'absorption exogène de glucose est augmentée chez les souris SOD1G93A au stade mi-symptomatique de la maladie
Les scientifiques ont ensuite cherché à déterminer si la gestion du glucose était altérée chez les souris SOD1G93A. Au début des symptômes, les souris SOD1G93A et leurs congénères normales ont répondu de manière similaire au glucose. Cependant, au stade mi-symptomatique de la maladie, les souris SOD1G93A ont montré un taux plus rapide de clairance de la glycémie.
Les auteurs ont ensuite confirmé que la perte de poids corporel chez les souris SOD1G93A n'était pas responsable de la baisse de concentration du glucose dans le sang. Bien que la concentration d'insuline de base soit restée inchangée, la réponse de l'insuline plasmatique au glucose exogène était significativement plus faible chez les souris SOD1G93A, avec une réduction de 44 % des concentrations d'insuline.
Au début de la maladie et à son stade symptomatique moyen il n'y avait aucune différence dans la zone immunoréactive du glucagon- cellules positives. Mais au stade mi-symptomatique McDonald et ses collègues ont trouvé dans le pancréas des souris SOD1G93A, une réduction de 22% des cellules β positives à l'insuline par rapport au pancréas de souris normales.
Malgré cette différence dans les concentrations de glycémie de base, les souris normales et SOD1G93A ont répondu de manière similaire à l'insuline.
Bien que les souris SOD1G93A pesaient moins au début et au milieu des symptômes, la quantité d'insuline n'avait aucune corrélation avec l'inverse des taux de glycémie. Cela indique que la détection du métabolisme oxydatif était inopérante ce qui est une des caractéristiques du diabète.
En plus des taux d'insuline et de glucagon, les auteurs ont également démontré que les concentrations de glycogène étaient 210 et 480 % plus élevées dans le foie des souris SOD1G93A respectivement aux stades d'apparition et au milieu des symptômes de la maladie.
La tolérance à l'insuline n'est pas affectée chez les souris SOD1G93A, malgré une baisse de la glycémie à jeun
Après un jeûne d'une nuit, l'accumulation de glycogène dans le foie était encore de 400 à 500 % plus élevée chez les souris SOD1G93A au milieu des symptômes par rapport à leurs congénères normales. Ces changements sont indépendants de l'insuline car il n'y avait pas de différence dans l'élimination du glucose en réponse à l'insuline exogène. De plus, les souris SOD1G93A présentent une réduction de la surface cellulaire exprimant de l'insuline et une altération de la libération d'insuline en réponse au glucose exogène. Les souris SOD1G93A ont également montré une accumulation de glycogène dans le foie, malgré une augmentation des concentrations de glucagon circulant et des données d'expression génique, suggérant une diminution à la fois de la synthèse et de la dégradation du glycogène. Cela indique que la signalisation du glucagon peut être altérée dans le foie des souris SOD1G93A. Enfin, le profil d'expression génique de plusieurs enzymes métaboliques a suggéré que le foie passe de l'utilisation du glucose aux acides gras comme source d'énergie, ce qui a déjà été trouvé dans le muscle squelettique et les tissus du SNC dans la SLA.
Cela confirme les résultats dans d'autres tissus affectés qui montrent un passage de l'utilisation du glucose aux lipides comme principale source de carburant pour le cycle du TCA. Bien que le déclencheur exact qui conduit à ce changement soit inconnu, il a été proposé qu'une augmentation du métabolisme des acides gras se produise pour compenser l'incapacité des tissus à utiliser le glucose et le glycogène comme substrats énergétiques. Bien qu'il s'agisse d'un mécanisme compensatoire bénéfique à court terme, la dépendance chronique au métabolisme des acides gras via la β-oxydation peut entraîner l'accumulation de sous-produits toxiques, en particulier des espèces réactives de l'oxygène (ROS).
Conclusion Ce qui est décrit dans cet article rappelle l’évolution du diabète. Au début du diabète, le pancréas produit normalement l'insuline. Les cellules des muscles utilisent de préférence les acides gras comme source d'énergie. Progressivement les cellules de l'organisme chargées de capter et d'utiliser le glucose deviennent insensibles à l'insuline. Le glucose ne pouvant entrer dans les cellules, les cellules bêta des îlots de Langerhans du pancréas vont produire plus d'insuline pour forcer la prise de glucose par les cellules. Dans cet article le mécanisme est un peu différent, au lieu de produire davantage d’insuline, le corps stocke le glucose sous forme de glycogène. Plus le diabète avance, plus les cellules bêta s'épuisent, jusqu'à disparaître. Cette disparition a aussi été constatée dans l’article. Par contre cela n’explique pas l’aspect local du début de la SLA et la progression géographique de la maladie, et c’est un travail sur des souris modèles de la SLA. On sait que les travaux sur des souris sont rarement transposable aux humains, particulièrement pour les maladies neurodégénératives. Cependant cet article est singulier. C’est un article qui parle de physiologie, il ne fait pas appel à d’obscures molécules auxquelles on affecte arbitrairement des rôles biologiques, il suggère pour la SLA un mécanisme qui n’a rien d’excentrique. Naturellement il reste encore de nombreuses inconnues, pourquoi la SLA démarre souvent par un muscle spécifique, puis progresse. De toute façon on ne sait pas plus soigner le diabète que la SLA, mais je crois qu’un pas important a été franchi.