Environ 80% des cancers du poumon sont des cancers du poumon non à petites cellules (CPNPC/NSCLC) et environ 15 à 20% de ces cellules sont porteuses de mutations activant le récepteur du facteur de croissance épidermique (EGFR).
Le traitement du CPNPC mutant EGFR s'est considérablement amélioré avec l'introduction d'inhibiteurs de la tyrosine kinase (ITK) de l'EGFR. Plusieurs ITK ciblant ce récepteur ont été développés, y compris les ITK EGFR de première génération, gefitinib (Iressa) et erlotinib (Tarceva).
Bien que les patients atteints de CPNPC mutés par l'EGFR tirent des avantages substantiels des ITK de l'EGFR, leur maladie a tendance à évoluer en l'espace d'un an parce que les tumeurs développent finalement une résistance aux traitements.
Les TKI EGFR de deuxième génération comprennent l'afatinib (Gilotrif) et le dacomitinib (Vizimpro), ainsi que le nératinib et les TKI EGFR de troisième génération, y compris l'osimertinib (Tagrisso), et les traitements thérapeutiques expérimentaux comme l'olmutinib et le nazartinib.
Les mutations d'EGFR activant les plus fréquentes dans le CPNPC incluent la délétion de l'exon 19 et L858R. Les patients dont les tumeurs hébergent ces mutations activant l'EGFR sont traités avec des ITK de l'EGFR de première génération. Bien que la plupart des patients aient initialement réagi à ces traitements, plus de 60% d’entre eux développent une résistance en acquérant la mutation ponctuelle «gatekeeper», T790M.
Des inhibiteurs de troisième génération, tels que l'osimertinib, ont été développés pour cibler les mutations de type T790M et pour être actifs contre la suppression de l'exon 19 d'origine et le L858R. Cependant, les patients développent également une résistance à ce traitement, par le biais de mécanismes de pontage alternatifs, comme décrit dans le tableau ci-dessous.
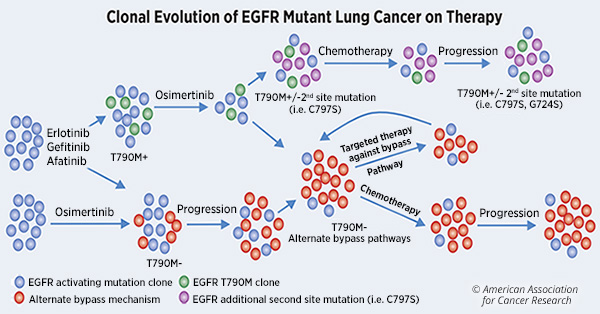
Le traitement ciblé des patients atteints de cancer du poumon porteurs de mutations de l'EGFR consistait uniquement en monothérapie avec divers inhibiteurs de la tyrosine kinase de l'EGFR, même si nous savons depuis plus de 10 ans qu'une partie des cancers résistant aux ITK de l'EGFR résultent de l'activation de la voie de dérivation MET.
Une résistance acquise par amplification du MET en tant que voie de dérivation est observée chez environ 5 à 10% des patients dont la maladie progresse après un traitement par des ITK de EGFR de première ou de deuxième génération et chez environ 25% de ceux dont la maladie progresse après un traitement par TKI de l'EGFR de troisième génération. La résistance induite par le MET confère un comportement plus agressif aux cancers avec EGFR mutants.
Combinaison d'osimertinib et de savolitinib
Une association d'osimertinib et du savolitinib, inhibiteur de MET étudié, a été testée chez sur une première cohorte de patients atteints d'un cancer du poumon mutant avec EGFR présentant une résistance acquise induite par une amplification de MET après un traitement par une ITK de EGFR de première ou de deuxième génération. Les tumeurs des patients étaient également négatives pour la mutation T790M.
Dans la deuxième cohorte, la même association a été testée chez des patients atteints d'un cancer du poumon mutant avec EGFR et présentant une résistance acquise induite par une amplification du métabolisme MET après un traitement par osimertinib ou un autre TKI expérimental de troisième génération de l'EGFR.
Le but cherché à travers l’étude des patients ayant reçu des ITK EGFR de première et deuxième génération antérieurs et de ceux ayant déjà reçu des ITK EGFR de troisième génération antérieurs dans deux cohortes distinctes était de fournir des évaluations plus précises de l’activité du traitement combiné dans ces deux groupes distincts de patients.
Pour la cohorte de patients ayant déjà reçu une ITK d'EGFR de première ou de deuxième génération, le traitement par l'association osimertinib-savolitinib couvre à la fois la mutation de résistance dominante actuelle (basé sur l'amplification MET) et une mutation de résistance future vraisemblable (basé sur T790m). "Dans cette branche, nous avons émis l'hypothèse que le taux de réponse serait élevé", a déclaré Sequist lors d'une interview.

Par contre, dans la cohorte de patients ayant déjà reçu des ITK EGFR de troisième génération (osimertinib ou l’un des autres ITK expérimentaux EGFR de 3ème génération), leur cancer a probablement acquis une résistance via T790M après un traitement par génération EGFR TKI, et à la suite du traitement avec une TFR EGFR de troisième génération couvrant le T790M, une deuxième mutation entraînée par une amplification du MET est apparue, ce qui a permis de distinguer leur maladie de celle de la première cohorte.
Dans la cohorte de 46 patients ayant déjà reçu une ITK d'EGFR de première ou de deuxième génération, le traitement à l'osimertinib associé au savolitinib a donné un taux de réponse objective (RRO) de 52%, avec 24 réponses partielles (PR). La durée médiane de réponse (DOR) était de 7,1 mois.
Dans la cohorte de 48 patients ayant déjà reçu une ITK d'EGFR de troisième génération, le traitement à l'osimertinib associé au savolitinib a donné un RRO de 28%, avec 12 PR. Le DOR médian était de 9,7 mois.
"Cette découverte illustre l'intérêt d'une sélection minutieuse des patients dans les études de thérapies ciblées", a déclaré Sequist, ajoutant: "Ces réponses cliniquement significatives démontrent également que, à mesure que différentes mutations de résistance hétérogènes apparaissent, elles peuvent à leur tour être contrôlées. en adaptant la thérapie. "
