S'il y a quelque chose de controversé à propos de la SLA (maladie de Charcot/Lou Gehrig), c'est la pratique d'une activité physique comme moyen de ralentir la progression de la maladie. Il y a quantité de témoignages contradictoires sur Internet. Cette confusion est engendrée par de multiples facteurs.
Le premier c'est peut-être que les médecins comme Charcot ont eu tort d'appeler d'un nom commun "SLA", un ensemble de maladies aux symptômes similaires. Au fur et à mesure de la progression de nos connaissances, et notamment face à l'absence de moyen de diagnostic indiscutable et après la découverte de multiples problèmes biologiques menant à ce type de maladie (mutations dans SOD1, FUS, C9orf72, TDP-43), agrégations de protéines malformés, diversité de phénotypes (spinal, bulbaire), durée de vie après diagnostic allant de 6 mois à 20 ans, les scientifiques auraient pu réviser cette catégorisation faite il y a 150 ans.
 Il y a aussi quelque chose de fondamentalement contre-intuitif, voire obscène, dans l'idée que pour ralentir la progression d'une maladie caractérisée principalement par la perte intense de masse musculaire, il faudrait faire davantage d’exercice physique. Pourtant on sait que chez des sujets sains l'absence de mouvement pendant quelques jours à la suite d'un alitement, fait fondre spectaculairement la masse musculaire et qu'il faut des semaines pour retrouver le niveau antérieur de masse musculaire.
Il y a aussi quelque chose de fondamentalement contre-intuitif, voire obscène, dans l'idée que pour ralentir la progression d'une maladie caractérisée principalement par la perte intense de masse musculaire, il faudrait faire davantage d’exercice physique. Pourtant on sait que chez des sujets sains l'absence de mouvement pendant quelques jours à la suite d'un alitement, fait fondre spectaculairement la masse musculaire et qu'il faut des semaines pour retrouver le niveau antérieur de masse musculaire.
Plusieurs études ont documenté une incidence plus élevée et un diagnostic de la SLA à un âge plus précoce chez les athlètes de haut niveau. Plusieurs études ont suggéré que les personnes ayant un mode de vie actif et une masse grasse corporelle réduite ont un risque accru de développer la SLA. Il semble avéré qu'une activité physique fréquente et intense favorise l'apparition de la SLA, en particulier chez les patients ayant un contexte génotypique prédisposant comme l’expansion de C9ORF72.
Des études récentes ont tenté de répondre à cette question, pour comprendre si l’activité physique pouvait être considérée comme un facteur dans l’étiologie de la SLA.
enter link description here
Un entraînement régulier d'intensité modérée réduit le stress oxydatif, diminue les niveaux de marqueurs inflammatoires chez les personnes âgées, aide à préserver la forme cardiovasculaire et la fonction cérébrale et protège les individus des effets négatifs du stress sur le vieillissement cellulaire.
Cependant, un entraînement physique intense génère des niveaux élevés de molécules réactives de l'oxygène (ROS) qui sont connues pour provoquer un stress oxydatif.
Les mitochondries sont le principal site de production de ROS, tout simplement parce que les mitochondries sont les organelles qui oxydent le glucose (il y a d'autres possibilités comme les lipides) qui a pu rentrer dans la cellule quand les récepteurs de celle-ci ont détecté la présence d'insuline dans le milieu intercellulaire. Le résultat de cette oxydation du glucose est une molécule nommée ATP, qui est une sorte de réservoir d'énergie qui est utilisé pour les différents processus interne à la cellule. Cette oxydation du glucose est un phénomène complexe qui produit des déchets dangereux, les fameuses espèces réactives de l'oxygène ROS, quand ils ne sont pas éliminés rapidement.
L'altération du métabolisme représente un événement précoce dans la SLA, il entraine une perte de poids et une masse grasse réduite, une altération de la gestion du glucose et des lipides et une augmentation des dépenses énergétiques au repos.
En conséquence, une teneur accrue en lipides alimentaires offre une neuroprotection et prolonge la survie, tandis que la restriction de l'apport calorique exacerbe les symptômes moteurs de la SLA.
Il a été largement démontré que la survie est meilleure chez les personnes ayant un IMC de l'ordre de 27 (surpoids). Il y a d'ailleurs sur ce site un calculateur de calorie pour personnes ayant la SLA:enter link description here
Bien entendu c'est un challenge extrême pour les malades de la SLA de manger davantage: Manque d'appétit, problèmes de déglutition, choix et attrait de nourritures de qualité alors que celles-ci doivent souvent être mixées.
Le passage du métabolisme vers l'utilisation des lipides précède la dénervation de la jonction neuromusculaire dans les modèles murins. Il est remarquable que l'administration de dichloroacétate (DCA), un acide organique halogéné, force le métabolisme vers l'oxydation du glucose, permet ainsi de contrebalancer le déséquilibre métabolique.
https://pubmed.ncbi.nlm.nih.gov/22509356/
Au vu de ces résultats, on s'attend à ce que des exercices physiques spécifiques déplacent le métabolisme énergétique musculaire soit vers un modèle lipidique, en cas d'exercice de faible intensité, soit vers un métabolisme glycolytique, en cas d'exercice de haute intensité. Bien entendu un exercice de haute intensité est le plus souvent impossible pour un malade de la SLA, ce qui fait qu’une solution médicamenteuse serait un préalable à la tenue d’exercise.
Chez les patients atteints de SLA, divers protocoles d’entraînement ont été proposés pour évaluer leurs effets bénéfiques potentiels.
Plusieurs protocoles d'exercices ont été testés chez des patients atteints de SLA et des modèles murins de la maladie. Outre les effets neuroprotecteurs exercés par toute activité physique, les protocoles basés sur la natation ont montré les résultats les plus positifs chez les souris.
En particulier, le protocole basé sur la natation a entraîné une augmentation remarquable de la durée de vie (chez les souris), et était associé à des changements dans le métabolisme énergétique des muscles squelettiques. Bien que la natation soit suggérée comme un type d'exercice avantageux dans de nombreux troubles neurologiques, son rôle bénéfique n'a pas encore été validé expérimentalement chez les patients atteints de SLA.
Dans l'ensemble, l'entraînement en endurance avec un soutien supplémentaire tel que la ventilation ou le soutien calorique à un IMC de surpoids semble avoir des effets positifs sur la capacité respiratoire, la fonctionnalité et la performance physique chez les patients atteints de SLA.
Ces études indiquent malheureusement que si l’entraînement en résistance augmente la force, la puissance et la vigueur musculaires, cela ne ralentit pas la progression de la maladie.
 Currently, the diagnosis of Alzheimer’s disease includes cognitive decline leading to dementia, associated with the observation of two major proteinopathies in the brain tissue. These two proteinopathies are plaques, formed by the aggregation of beta-amyloid proteins, and tangles, which are composed of hyperphosphorylated tau proteins.
Currently, the diagnosis of Alzheimer’s disease includes cognitive decline leading to dementia, associated with the observation of two major proteinopathies in the brain tissue. These two proteinopathies are plaques, formed by the aggregation of beta-amyloid proteins, and tangles, which are composed of hyperphosphorylated tau proteins.
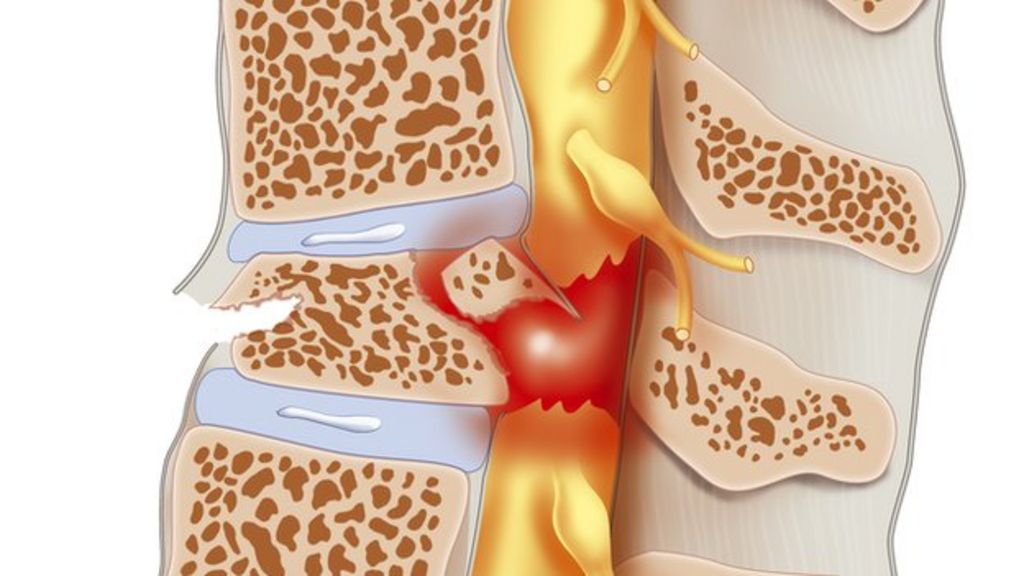 Si dans la SLA/Maladie de Charcot les neurones moteurs meurent (ce dont je ne suis pas sûr
Si dans la SLA/Maladie de Charcot les neurones moteurs meurent (ce dont je ne suis pas sûr  C’est un progrès conséquent de l’état de l’art. Par contre ce neurone moteur ne s’est pas connecté via des synapses à d’autres cellules comme d’autres neurones moteurs, des interneurones ou des cellules de fibres musculaires. Il ne s’agit que d’un seul neurone, très court, pas des milliers de neurones moteurs long jusqu'à un mètre, qui composent la moelle spinale. De plus des neurones qui ne seraient pas accompagnés par une multitude de cellules non-neuronales (astrocytes, oligodendrocytes, etc..), mourraient rapidement. Enfin dans la moelle spinale il n’y a pas que des neurones moteurs.
C’est un progrès conséquent de l’état de l’art. Par contre ce neurone moteur ne s’est pas connecté via des synapses à d’autres cellules comme d’autres neurones moteurs, des interneurones ou des cellules de fibres musculaires. Il ne s’agit que d’un seul neurone, très court, pas des milliers de neurones moteurs long jusqu'à un mètre, qui composent la moelle spinale. De plus des neurones qui ne seraient pas accompagnés par une multitude de cellules non-neuronales (astrocytes, oligodendrocytes, etc..), mourraient rapidement. Enfin dans la moelle spinale il n’y a pas que des neurones moteurs. Ces cellules, contrairement aux neurones, ressemblent plus à leurs consoeurs du reste du corps à la fois par la morphologie et la durée de vie. A l'inverse un neurone est caractérisé par un ou plusieurs appendices dendritiques et axonaux et ne se reproduisent pas. Les neurones ont besoin des astrocytes et de nombreux autres types de cellules pour survivre.
Ces cellules, contrairement aux neurones, ressemblent plus à leurs consoeurs du reste du corps à la fois par la morphologie et la durée de vie. A l'inverse un neurone est caractérisé par un ou plusieurs appendices dendritiques et axonaux et ne se reproduisent pas. Les neurones ont besoin des astrocytes et de nombreux autres types de cellules pour survivre. Il y a aussi quelque chose de fondamentalement contre-intuitif, voire obscène, dans l'idée que pour ralentir la progression d'une maladie caractérisée principalement par la perte intense de masse musculaire, il faudrait faire davantage d’exercice physique. Pourtant on sait que chez des sujets sains l'absence de mouvement pendant quelques jours à la suite d'un alitement, fait fondre spectaculairement la masse musculaire et qu'il faut des semaines pour retrouver le niveau antérieur de masse musculaire.
Il y a aussi quelque chose de fondamentalement contre-intuitif, voire obscène, dans l'idée que pour ralentir la progression d'une maladie caractérisée principalement par la perte intense de masse musculaire, il faudrait faire davantage d’exercice physique. Pourtant on sait que chez des sujets sains l'absence de mouvement pendant quelques jours à la suite d'un alitement, fait fondre spectaculairement la masse musculaire et qu'il faut des semaines pour retrouver le niveau antérieur de masse musculaire. Studies have shown that immune cells in the brain, particularly microglia, and astrocytes, are key regulators of the inflammatory response in the central nervous system and are involved in the pathogenesis of AD. These cells have various roles, including supporting neurons.
Studies have shown that immune cells in the brain, particularly microglia, and astrocytes, are key regulators of the inflammatory response in the central nervous system and are involved in the pathogenesis of AD. These cells have various roles, including supporting neurons.