Ce nouveau post concerne un article écrit par des médecins et scientifiques français. Il offre une perspective intéressante sur l’organisation des soins de la SLA (souvent appelée maladie de Charcot en France).
L’objet de l’article est en quelque sorte de créer un consensus autour du médicament Relyvrio (ex : AMX0065). Mais ce qui m’intéresse dans cet article c’est comment les praticiens voient le traitement de la SLA en France. Je remercie l’auteur principal, le professeur Julien Cassereau
du service de neurologie du CHU d’Angers, de m’avoir communiqué cet article.
Ce post ne prétend pas refléter fidèlement cet article, ce n'est que mon commentaire de non-spécialiste.
Aujourd’hui l’organisation des soins en France est similaire à celle que l’on peut trouver dans les pays Anglo-Saxons ou Nordiques. Les nouveaux diagnostiqués sont référés par les neurologues à des centres de soins de la SLA. Il n’en a pas toujours été ainsi. Jusqu’à il y a une quinzaine d’année il n’y avait pas de centres de soins de la SLA au niveau national, ceci dans un contexte où les médecins (généralistes ou neurologues) considéraient qu’il n’y avait que des soins palliatifs à assurer, car le décès serait rapide, ce qu’il était en général.
S’en est ensuivi une période où des centres ont apparu et disparu quelques années plus tard (ex : St Brieuc). Jusqu’à récemment il y avait deux réseaux de soins de la SLA en France, l’un purement d’origine locale, l’autre affilié à une organisation au niveau européen. Sachant qu’il y a d’excellents spécialistes de la SLA en Allemagne (comme Albert Ludolph), cette dernière organisation me semble très préférable pour les montées en compétences.
L’article prévient qu’il n’y a qu’un seul médicament sur le marché en France, le Riluzole, mais il ne mentionne pas les médicaments autorisés dans d’autres pays. Pourtant cet article est indirectement un plaidoyer pour l'utilisation du Relyvrio (AMX0035).
- Aux USA, il y a deux variantes du riluzole, le Exservan et le Tiglitik, ce qui est très utile pour les malades qui ont énormément de problèmes de déglutition. Il y a Radicava (edaravone) mais celui ci n’a pas été autorisé en Europe. Relyvrio est autorisé de façon conditionnelle. Il y a aussi Qalsody (ex : tofersen) qui ne concerne que les porteurs d’une certaine mutation du gène SOD1, c’est-à-dire une partie très minoritaire des malades de la SLA.
Qalsody a créé une polémique car son essai de phase III a échoué, pourtant Biogen a réussi à convaincre la FDA que l’impact sur les biomarqueurs est annonciateur d’un bienfait futur pour les malades.
Celà a d’ailleurs inspiré d'autres acteurs de cette industrie qui plaident maintenant pour que le diagnostic d’Alzheimer soit fait à partir des biomarqueurs au lieu de la symptomatologie, car de nombreux médicaments améliorent ces résultats de biomarqueurs sans pour autant réussir à stopper la progression de la maladie d’Alzheimer.
Au Japon outre Riluzol et Radicava, Qalsody possède aussi une autorisation de mise sur le marché. Fait curieux, un exosquelette possède lui aussi cette autorisation car il permet (paraît-il) une amélioration de la marche.
En Chine pour la SLA, en plus du Riluzole on administre du Nusinersen. C’est un médicament un peu controversé pour une autre maladie d’origine génétique et un peu similaire à la SLA, la SMA, qui frappe surtout les bébés. A priori il est difficile de comprendre en quoi Nusinersen pourrait aider les malades de la SLA.
Un Comité de Pilotage de cinq experts ALS, répartis sur la France métropolitaine a été constitué pour diriger l’élaboration et l’administration d’un questionnaire. Tous les membres du comité de pilotage provenaient des centres SLA français.
Le questionnaire a été hébergé en ligne et comprenait 27 questions principales divisées en cinq
sections:
Quels outils et critères pour le diagnostic de la SLA?
Opinion sur El Escorial et ALSFRS-R?
Comment est évalué la progression de la SLA?
Opinion sur les traitements actuels.
Opinion sur les traitements futurs.
Une méthodologie Delphi (une recherche de consensus) a été utilisée, impliquant deux tours de vote à distance par les participants au panel, et une finale réunissant des membres du comité de pilotage pour discuter et valider les résultats obtenus.
Les réponses du premier tour de vote ont été analysées et synthétisées, et les réponses ne donnant pas lieu à consensus ont été soumises à nouveau au deuxième tour.
Lors du second tour de scrutin, les participants ont eu, pour chaque question, la possibilité de commenter leur réponse.
Parmi les 64 experts contactés, 24 experts exerçant dans 17 centres SLA sur les 19 que compte la France ont complété le questionnaire aux deux tours.
Ces experts traitaient en moyenne plus de 150 patients par an. Cela contraste considérablement avec un médecin généraliste qui verra peut-être seulement un nouveau malade au cours de sa vie professionnelle.
Pour confirmer le diagnostic de SLA dans la pratique quotidienne, les répondants ont validé l'utilisation des critères de Gold Coast (71 %). Il n'y a pas eu de consensus sur l'utilisation des critères révisés d'El Escorial ou d'Awaji dans la pratique. Ce qui est une bonne nouvelle pour les malades, car les critères de Gold Coast sont les plus récents.
Il est notoire que les critères révisés d’El Escorial et d’Awaji sont complexes à appliquer et sujets à erreur.
Les critères « El Escorial » datent de 1994, et ont révisé en 1998.
En 2006, les critères « Awaji » proposaient d'utiliser les tests EMG et NCV en complément pour aider à diagnostiquer la SLA plus tôt. Pour moi les tests EMG et NCV qui datent des années 1950, nécessitent une cascade d’interprétations qui en pratique sont différentes d’un neurologue à l’autre.
Les critères « Gold Coast » reconnaissent que la SLA peut toucher bien plus que le système moteur et que des troubles cognitifs, comportementaux et psychiatriques peuvent faire partie de la maladie.
Ces critères tranchent aussi le débat de sous-types de la SLA. Dans la littérature certains ont distingués de multiples sous-types de SLA, c'est encore le cas aux USA. Pour les critères « Gold Coast » il y a SLA s’il y a présence:
d'un dysfonctionnement progressif des motoneurones supérieurs et inférieurs dans au moins une région du corps
ou d'un dysfonctionnement progressif des motoneurones inférieurs dans au moins deux régions du corps.
Ces critères encouragent l’utilisation de technologies modernes telles que l’imagerie médicale.
Chez les praticiens français interrogés, il y avait également un consensus sur l'intérêt du diagnostic différentiel et l'existence de critères corrélés à la survie au diagnostic (96 %), mais l'échelle Milan-Turin (MITOS) n'était pas un critère utilisé pour estimer la survie des patients (79%). Là aussi cela fait sens, la SLA n’est pas une maladie où les symptômes correspondent à ceux décrits dans les manuels. Chaque cas est différent, certains malades décèdent en six mois, d’autres ont une espérance de vie normale (mais jamais une vie normale) et il est impossible de décrire par quelles étapes un malade va passer, même si chaque nouvelle étape semble arriver beaucoup trop vite.
Plus étonnant, les experts français interrogés déclarent qu’ils utilisent systématiquement l'échelle ALSFRS-R pour évaluer la déficience fonctionnelle des patients, et 88 % d’entre eux déclarent que l'évaluation indépendante des sous-scores ALSFRS-R était plus intéressante que le score global. Ce n’est certainement pas le consensus international à ce sujet : L'échelle ALSFRS-R est purement observationnelle, elle est très imprécise pour juger de la santé d’un patient, en effet l’ajout d’un simple équipement suffit pour améliorer un score.
En ce qui concerne les patients, et là il n’y a rien de nouveau: En moyenne sur un an, un patient sur six est hospitalisé en raison de complications. De plus, le délai moyen entre l’apparition des premiers symptômes et la première hospitalisation est de 2 ans.
Les spécialistes de la SLA ont convenu de la nécessité d'instaurer un traitement médicamenteux neuroprotecteur dès le diagnostic de la SLA, car une prise en charge précoce de ces patients est importante. Le panel a considéré qu'une prise en charge précoce devrait s'effectuer moins de six mois après l'apparition des symptômes.
Cependant, en pratique, la prise en charge des patients dans les six mois suivant l’apparition des symptômes reste très rare, puisque le délai moyen entre l’apparition des symptômes et le diagnostic de SLA est de 10 mois. Les patients que les praticiens priorisent sont généralement associés à un mauvais pronostic, car ils représentent souvent des formes plus sévères de la maladie (par exemple les formes bulbaires).
Selon le panel d'experts, un futur traitement contre la SLA devrait répondre à plusieurs objectifs complémentaires. L'objectif prioritaire serait pour un tiers des répondants de ralentir la progression de la maladie, puis la prolongation de la survie des patients (25%) et la limitation de la dégradation de la qualité de vie des patients (25%) et enfin la prolongation de l'autonomie des patients (12,5%).
Le consensus semble faible, il s’agit évidemment là de concepts différents et il y a forcément une part émotionnelle dans la priorisation de ces objectifs.
Cela reflète aussi le spectre large de phénotypes de cette maladie, le soignant d’un malade qui sait que statistiquement son allèle lui donne 6 mois à vivre n’a probablement beaucoup d’intérêt pour la prolongation de l'autonomie des patients. Inversement cette question est de la plus haute importance pour des soignants de patients qui vivront une progression extrêmement lente.
Il a ensuite été demandé aux spécialistes de positionner un produit non spécifié dans leur stratégie thérapeutique pour les patients SLA. Dans l’esprit du comité de pilotage ce produit non spécifié aurait les caractéristiques alors projetées du Relyvrio (ex : AMX0065).
Sur la base de son profil d'efficacité et de sécurité, les experts ont indiqué que le produit X aurait leur confiance dans le traitement de la SLA. Sachant qu’il n’y a actuellement qu’un seul médicament autorisé en France, qu’il n’y en a pas eu d’autres depuis 20 ans, on ne peut pas s’étonner de cette réponse.
Pour autant la firme Amylyx a beaucoup communiqué et il me semble très probable que les médecins connaissaient le Relyvrio quand ils répondaient.
La conclusion reprend les principaux points issus de l’analyse des réponses, dont l’intérêt des praticiens pour une nouvelle médication.
Je voudrais rajouter des commentaires sur Relyvrio, parce qu'il me semble que la situation est beaucoup moins simple qu'il n'y paraît.
Relyvrio (ex : AMX0035) est un traitement oral qui pourrait aider à ralentir la progression de la maladie chez les adultes atteints de sclérose latérale amyotrophique (SLA).
Pour moi, et parce que j’ai échangé avec des personnes proches d’Amylyx, Relyvrio a été délibérément conçu comme associant un produit ayant une efficacité reconnue au moins par les patients (TUDCA) avec un autre médicament ayant déjà une autorisation de mise sur le marché (ce qui permet d’éviter les coûts liés aux études de toxicité). L’ensemble est alors brevetable, alors que TUDCA tout seul ne l’est pas.
Un essai clinique de phase II CENTAUR (NCT03127514) a semblé montrer que la thérapie réduit le déclin fonctionnel et prolonge la survie des patients. Cependant cette conclusion a été contestée par des médecins, notamment parce que la qualité méthodologique semble discutable. Clairement le comité d’évaluation de la FDA n’était pas non plus convaincu. De plus c’est très inhabituel qu’un essai de phase II aboutisse à une demande de mise sur le marché.
Les accords de subvention d'Amylyx avec l' « ALS Association » et « ALS Finding a Cure » oblige Amylyx à payer des redevances à l' « ALS Association » et « ALS Finding a Cure » au fil du temps d'un montant égal à 150 % des subventions reçues jusqu'à un maximum de 2,3 millions de dollars. L'ALS Association a demandé sans succès l'approbation rapide de l'AMX0035 par la FDA et a ensuite déclenché une offensive médiatique importante aux USA, à laquelle l’état fédéral a été obligé de répondre par différentes initiatives, certaines réglementaires, d’autres d’ordre budgétaires.
La communication à outrance fait maintenant partie de l’arsenal des entreprises du domaine pharmaceutique, particulièrement quand il s’agit de très petites sociétés. On a vu il y a quelques années des malades de la SLA très médiatisés proclamer sur les réseaux sociaux qu’ils avaient été quasiment guéris par tel ou tel médicament en cours d’essai clinique. Ces malades ont posté des photos et vidéos d'eux-mêmes dans des clubs de gymnastique, ou être capable de refaire de la moto, suggérant ainsi un progrès énorme de leur état de santé qui serait dû au médicament qui leur était alors administré. Pourtant à ce jour le médicament auquel je fais référence n’a toujours pas été autorisé par la FDA malgré de multiples demandes de la société en question.
Fort heureusement ce n'a pas été le cas pour Amylyx, mais en France on a vu sur les réseaux sociaux nombre de personnes considérer que Relyvrio était un médicament miracle.
Normalement c’est à la suite d’un essai réussi de phase III qui porte dans le cas de la SLA sur au moins 500 patients et dans le cas d’un cancer plutôt sur 5000 patients qu’on autorise ou non un médicament à être mis sur le marché. La mise sur le marché dans notre pays implique aussi la question de son remboursement par la sécurité sociale, alors qu’aux USA cette question est du domaine des mutuelles privées.
L’étude CENTAUR portait sur 135 patients, dont la moitié avait reçu du Relyvrio. Avec des nombres aussi faibles il n’est pas recommandé de faire des études statistiques. De plus si l’on fait une analyse post-hoc sur des sous groupes de patients, on peut prouver n’importe quelle thèse. Les groupes pharmaceutiques essayent hélas de normaliser l’utilisation d’analyses post-hoc auprès des autorités de régulation.
Relyvrio fait l'objet d'un agrément provisoire aux Etats-Unis, qui devrait évoluer en fonction des résultats de l’essai de phase III PHOENIX (NCT05021536). Au Canada, la thérapie est déjà vendue sous la marque Albrioza. Relyvrio est en cours d'examen réglementaire en vue d'une éventuelle approbation pour l'ALS en Europe. Il est également étudié comme traitement potentiel pour d’autres troubles neurodégénératifs, notamment la maladie d’Alzheimer et le syndrome de Wolfram.
L’étude PHOENIX (NCT05021536) dont le résultat conditionne la pérénisation de l'agrément du Relyvrio aux USA, porte sur 664 personnes atteintes d’une SLA diagnostiquée depuis peu, c’est-à-dire celles qui présentaient des symptômes depuis moins de deux ans, car c’est sans doute chez ces patients qu’il y a le plus de chance de détecter une éventuelle amélioration.
L’étude devrait durer deux fois le temps habituel (48 semaines), et sera suivi d'un traitement ouvert pendant deux ans maximum. Ces deux points (SLA diagnostiquée depuis peu et durée d'essai très longue) découlent d’un sentiment nouveau qui est que les essais cliniques classiques sont peu adaptés à des maladies chronique, ce que je veux bien croire. Par exemple il commence à y avoir des thérapies pour les cas de moelle épinière sectionnés, mais ces thérapies miraculeuses demandent au moins deux ans avant que le malade ne recouvre un usage (partiel) de ses membres inférieurs. Ces thérapies n’ont aucune chance d’être acceptées dans le cadre d’une étude clinique classique.
L'étude PHOENIX est menée sur des sites aux États-Unis et en Europe et devrait se terminer en 2024. Personne ne peut prédire quel en sera le résultat. J’espère que ce sera un grand succès, mais on a vu avec des médicaments comme l’Arimoclomol qui possède un mécanisme d’action à priori très clair dans le domaine de la SLA, échouer à un essai clinique de phase III.
Si cet essai réussi, il va aussi soulever des questionnements chez des concurrents d’Amylyx, nombre de médicaments (41!) ont réussi lors d’une phase II de traitement de la SLA, mais ont échoués lors de la phase III.
Un nombre non négligeable de ces médicaments montraient un ralentissement statistiquement non significatif de la progression de la SLA ou une diminution des biomarqueurs. On pense au moins à Edaravone, Arimoclomol ou des neurotrophiques comme IGF1 et GDNF. Il est possible que le nombre de médicaments autorisés par la FDA et l’EU explose au cours des prochaines années.
Dans ce cas et dans le même état d’esprit que celui d’Amylyx, pourquoi ne pas envisager des polythérapies pour le traitement de la SLA?
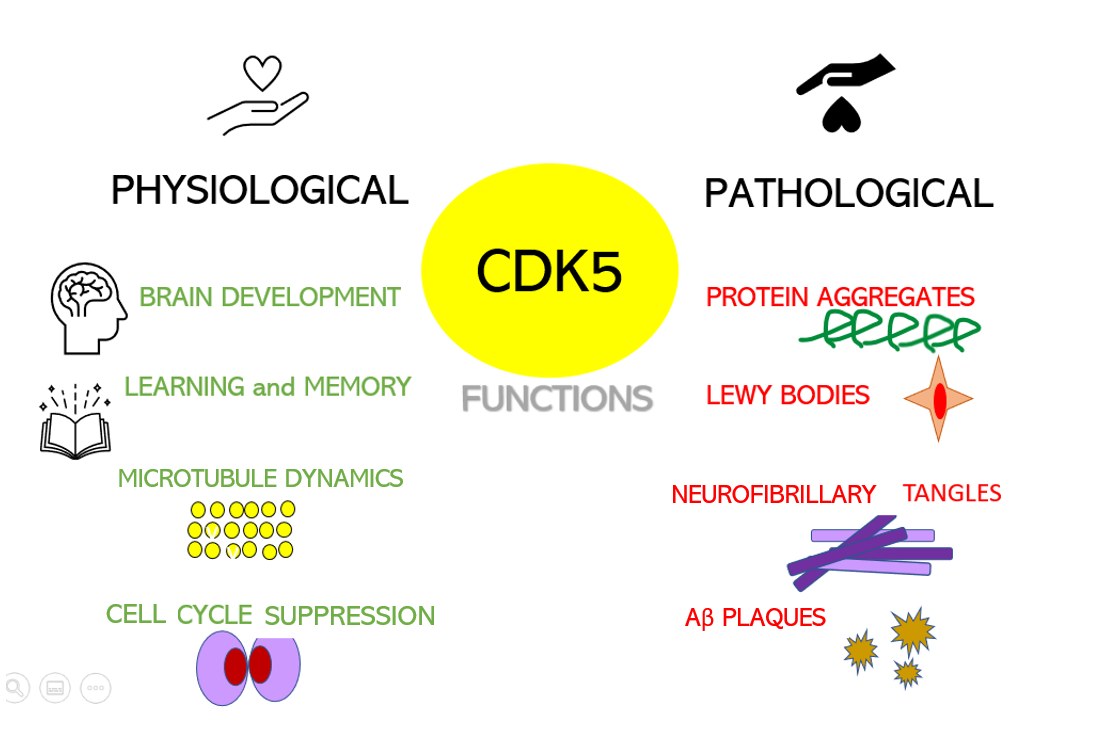 Dysregulation of CDKs, particularly cyclin-dependent kinase 5 (Cdk5), is seen in many neurological disorders, including Alzheimer's disease (AD) and Parkinson's disease (PD). Cdk5 is a unique member of the CDK family because it does not play a critical role in cell cycle progression and is not activated by a cyclin. Instead, Cdk5 is normally activated by the regulatory protein p25. Cdk5/p35/p25 activity is normally an important regulator of the proper development of the mammalian central nervous system.
Dysregulation of CDKs, particularly cyclin-dependent kinase 5 (Cdk5), is seen in many neurological disorders, including Alzheimer's disease (AD) and Parkinson's disease (PD). Cdk5 is a unique member of the CDK family because it does not play a critical role in cell cycle progression and is not activated by a cyclin. Instead, Cdk5 is normally activated by the regulatory protein p25. Cdk5/p35/p25 activity is normally an important regulator of the proper development of the mammalian central nervous system.
 Their results show that the model can identify, from 3 seconds of magnetoencephalographic signals, the corresponding speech segment with up to 41% accuracy, which is, however, lower than previous results. Furthermore, we know that
Their results show that the model can identify, from 3 seconds of magnetoencephalographic signals, the corresponding speech segment with up to 41% accuracy, which is, however, lower than previous results. Furthermore, we know that  If I extrapolate from Figure 6, patients with two treatments would live 13 years longer than patients without treatment. This improvement is considerable, if we ignore the statistical hallucinations of pharmaceutical companies, the current improvements simply relate to a few months of survival. We will see below that we can doubt this result.
If I extrapolate from Figure 6, patients with two treatments would live 13 years longer than patients without treatment. This improvement is considerable, if we ignore the statistical hallucinations of pharmaceutical companies, the current improvements simply relate to a few months of survival. We will see below that we can doubt this result. Any way at least if it works in human patients with FUS/C9orf72 that would mean one in five ALS patients would benefit from it. This would be much larger than Qualsody benefits.
Any way at least if it works in human patients with FUS/C9orf72 that would mean one in five ALS patients would benefit from it. This would be much larger than Qualsody benefits. There was a reduced risk of death observed in patients exposed to a higher dosage (defined as ≥ 1000 mg/day) of TUDCA compared to both the control group and those with lower TUDCA dosages.
There was a reduced risk of death observed in patients exposed to a higher dosage (defined as ≥ 1000 mg/day) of TUDCA compared to both the control group and those with lower TUDCA dosages. Yet it's been known for a long time that granules are formed when cells encounter a stress event. Stress granules disappear as soon as the cell resumes its normal functioning.
Yet it's been known for a long time that granules are formed when cells encounter a stress event. Stress granules disappear as soon as the cell resumes its normal functioning. The authors' claims are impressive:
"We found that administering CDNF to ALS mice and rats significantly improved their motor behavior and stopped the progression of paralysis symptoms. The improvement in symptoms was reflected in an increased number of surviving motor neurons in the spinal cord. spinal cord of animals compared to rodents that did not receive “CDNF. Our experiments suggest that CDNF could rescue motor neurons by reducing the ER stress response and, consequently, cell death. Importantly, ER stress was present in all of our animal models, regardless of specific genetic mutations,” explains study lead author Dr. Francesca De Lorenzo.
The authors' claims are impressive:
"We found that administering CDNF to ALS mice and rats significantly improved their motor behavior and stopped the progression of paralysis symptoms. The improvement in symptoms was reflected in an increased number of surviving motor neurons in the spinal cord. spinal cord of animals compared to rodents that did not receive “CDNF. Our experiments suggest that CDNF could rescue motor neurons by reducing the ER stress response and, consequently, cell death. Importantly, ER stress was present in all of our animal models, regardless of specific genetic mutations,” explains study lead author Dr. Francesca De Lorenzo.