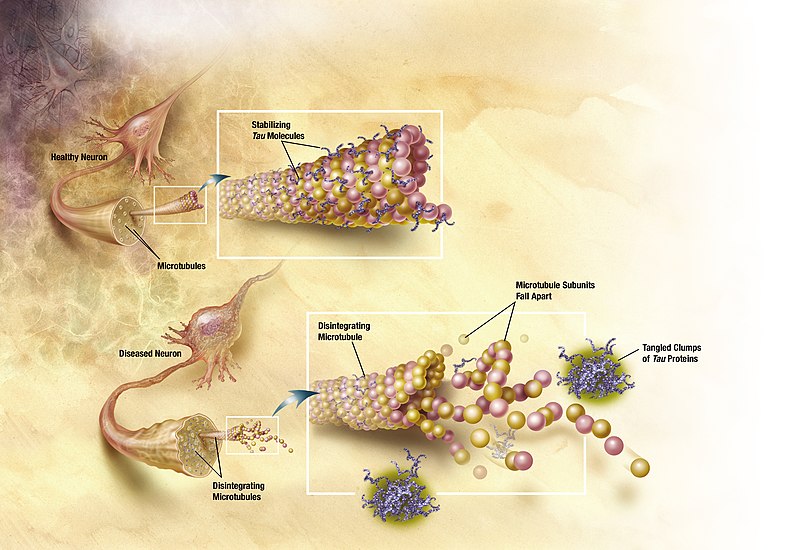
Les protéines Tau stabilisent les microtubules assurant la forme de la cellule. Elles sont abondants dans les neurones du système nerveux central et moins communes ailleurs. Des pathologies et les démences du système nerveux telles que la maladie d'Alzheimer et la maladie de Parkinson sont associées à des protéines Tau devenues défectueuses et ne stabilisent plus correctement les microtubules.
Dans un article publié le 19 novembre 2019 dans le Journal of Alzheimer's Disease intitulé "In Vivo Validation of a Small Molecule Inhibitor of Tau Self-Association in htau Mice", des chercheurs ont rapporté qu'une petite molécule inhibait la protéine Tau auto-associée dans l'hippocampe d'un modèle murin de tauopathie qui exprime les six isoformes de la protéine Tau humaine.
Les oligomères Tau joueraient un rôle influent dans la progression de la maladie d'Alzheimer et des tauopathies associées. En effet il a été démontré que les oligomères Tau transmettaient la pathologie Tau, des neurones malades aux neurones sains, par le biais de l'ensemencement du repliement Tau et de l'agrégation.
Afin de développer une petite molécule thérapeutique pour la maladie d'Alzheimer et les tauopathies associées, Davidowitz et d'autres chercheurs ont développé des tests in vitro et cellulaires afin de sélectionner des molécules inhibant la première étape de l’agrégation de la protéine Tau, l’auto-association de la protéine Tau en oligomères.
Des études de validation in vivo d'un composé principal optimisé ont été réalisées indépendamment dans le modèle murin de tauopathie hTau qui exprime les isoformes humaines de Tau. Les souris traitées ne présentaient aucun événement indésirable lié à l'administration de la molécule.
Le médicament a réduit de manière significative le niveau de protéine Tau auto-associée et d'agrégats totaux et phosphorylés de Tau insolubles. La réponse à la dose était linéaire par rapport aux niveaux de composé dans le cerveau.
Une étude de confirmation a été réalisée avec des souris hTau mâles qui ont donné des résultats cohérents. Les résultats ont validé l'approche de dépistage en montrant que le ciblage de l’auto-association Tau peut inhiber l’ensemble de la voie de l’agrégation de Tau en utilisant le composé principal sélectionné et optimisé dont l’activité a été traduite par des essais in vitro et cellulaires sur un modèle in vivo d’agrégation de Tau.
"Cette étude valide l'approche d'Oligomerix pour inhiber l'agrégation de Tau et montre que cibler la formation d'oligomères de Tau au début de la cascade d'agrégation peut inhiber l'ensemble de la voie d'agrégation en aval", a commenté James Moe, Ph.D., MBA, président et directeur général d'Oligomerix, et un des auteurs de la publication.

