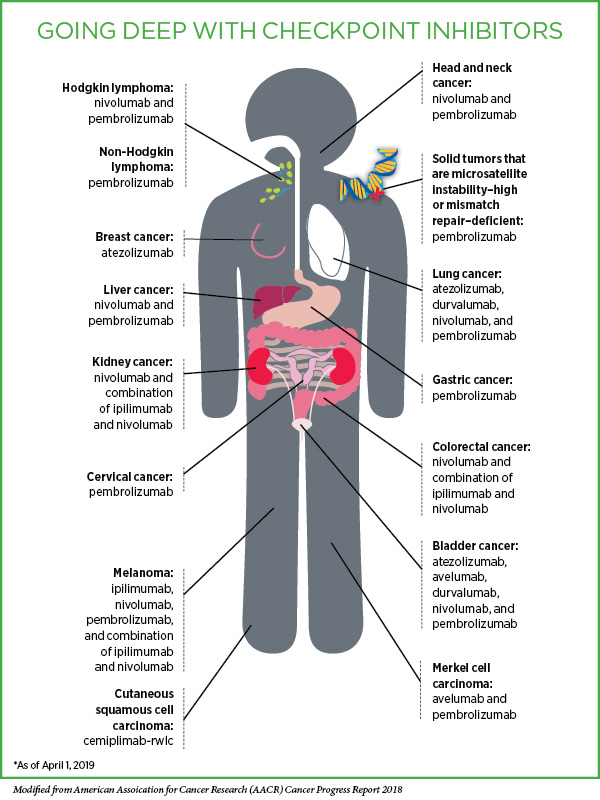
les organismes vivants utilisent l'énergie de façon radicalement différente de la façon de celle des cellules immunitaires in-vitro.
Pendant des années, les scientifiques ont utilisé des cellules cultivées dans des boîtes de Pétri pour étudier les processus métaboliques qui alimentent le système immunitaire. Mais un nouvel article suggère que les organismes vivants utilisent l'énergie de façon radicalement différente de la façon de celle des cellules immunitaires in-vitro.
Le consensus scientifique depuis les travaux de Warburg, est que les cellules immunitaires, appelées cellules T, convertissent du glucose en énergie pour alimenter la fonction cellulaire. En fait il y a différents mécanismes par lequel une cellule peut obtenir de l'énergie, ce que l'on appelle métabolisme ou aussi respiration.
Comment les cellules acquièrent-elle de l'énergie?
on distingue d'une part l'anabolisme, qui représente l'ensemble des voies de biosynthèse des constituants cellulaires, et d'autre part le catabolisme, qui représente l'ensemble des voies de dégradation de ces constituants cellulaires en petites molécules pour en libérer l'énergie par oxydation ou pour rebâtir d'autres constituants cellulaires.
On peut différencier le catabolisme en respiration aérobie et anaérobie. La respiration aérobie comprend la glycolyse, la décarboxylation oxydante du pyruvate, le cycle de l'acide citrique, la phosphorylation oxydative.
La principale voie de dégradation est la glycolyse, où des sucres tels que le glucose et le fructose sont convertis en pyruvate et génèrent de l'ATP. Le pyruvate est un intermédiaire dans plusieurs voies métaboliques, mais la majorité est convertie en acétyl-CoA par glycolyse aérobie (avec oxygène) et introduite dans le cycle de l'acide citrique.
Les lipides sont catabolisés par hydrolyse en acides gras libres et en glycérol. Le glycérol entre dans la glycolyse et les acides gras sont décomposés par bêta-oxydation pour libérer de l'acétyl-CoA, qui est ensuite introduit dans le cycle de l'acide citrique.
Il existe deux voies de formation de méthane microbiennes importantes, par réduction du carbonate (respiration) et fermentation par l'acétate.
Warburg a émis l'hypothèse que la croissance du cancer est causée par des cellules tumorales générant de l'énergie (comme, par exemple, l'adénosine triphosphate / ATP) principalement par la dégradation anaérobie du glucose (appelée fermentation ou respiration anaérobie). Cela contraste avec les cellules saines, qui génèrent principalement de l'énergie à partir de la décomposition oxydante du pyruvate. Le pyruvate est un produit final de la glycolyse et est oxydé dans les mitochondries. Par conséquent, selon Warburg, le cancer devrait être interprété comme un dysfonctionnement mitochondrial.
Pour les organismes multicellulaires, lors de brèves périodes d'activité intense, les cellules musculaires utilisent la fermentation pour compléter la production d'ATP à partir de la respiration aérobie plus lente.
Qu'est-ce qui a été découvert?
Jones et ses collègues ont découvert que les cellules T dans un système vivant utilisent le glucose comme éléments de base pour la réplication de l'ADN et d'autres tâches de maintenance, en plus de la conversion du glucose en énergie brute. Ils ont également découvert que la façon dont les cellules T traitent le glucose évolue au cours d'une réponse immunitaire. Le métabolisme du glucose dans les cellules T change de façon dynamique au cours d'une réponse immunitaire. La biosynthèse de la sérine dépendante du glucose favorise la prolifération des lymphocytes T in vivo.

Ce qui suggère que les cellules T peuvent utiliser les ressources de manière différente dans le corps lorsqu’elles combattent une infection bactérienne telle que Listeria ou une maladie comme le cancer.
Les cellules T naïves CD8 + se différenciant en cellules T effectrices augmentent l'absorption du glucose et le passage du métabolisme au repos au métabolisme anabolique. Bien que l'on en sache beaucoup sur le métabolisme des cellules T en culture, la façon dont les cellules T utilisent les nutriments au cours de la réponse immunitaire in vivo est moins bien définie. Les chercheurs ont donc combiné les techniques de profil bioénergétique et de perfusion de glucose 13C pour étudier le métabolisme des lymphocytes T CD8 + répondant à une infection par Listeria.
Contrairement aux cellules T activées in vitro, qui présentent le métabolisme de Warburg, les cellules T CD8 + activées physiologiquement présentaient des taux plus élevés de métabolisme oxydatif, une capacité bioénergétique plus élevée, une utilisation différentielle du pyruvate et un flux important du carbone 13C-glucose vers les voies anaboliques, y compris la biosynthèse des nucléotides et de la sérine. La biosynthèse de la sérine dépendante du glucose induite par l’enzyme Phgdh était essentielle à l’expansion des cellules T CD8 + in vivo.
Nos cellules immunitaires ne fonctionnent pas en vase clos
"Cela revient à observer le comportement des animaux dans un zoo ou dans la nature. Nos cellules immunitaires ne fonctionnent pas en vase clos - elles travaillent de concert avec une foule d'autres cellules et facteurs qui influencent le mode et le moment d'utilisation de l'énergie, "a déclaré Russell Jones, Ph.D., auteur principal de l'étude et responsable du groupe de programmation métabolique et nutritionnelle de l'Institut Van Andel. "Comprendre le métabolisme cellulaire est un élément crucial du développement thérapeutique. Nos résultats renforcent la nécessité d'étudier ces cellules dans un environnement aussi proche que possible de la nature."
Les résultats ont des implications profondes sur la façon dont les scientifiques étudient les systèmes complexes et interconnectés qui sous-tendent la santé et la maladie et sur la manière dont ils traduisent ces informations en de nouvelles stratégies de diagnostic et de traitement.
"Les cellules immunitaires réagissent de manière beaucoup plus dynamique aux infections et aux maladies que nous ne le pensions auparavant", a déclaré Jones. "Pendant un certain temps, nous en sommes à un stade de la recherche sur le métabolisme, c'est comme si nous étions dans l'obscurité sous un réverbère. Nous ne pouvions voir que devant nous. Ces résultats nous aideront à mieux comprendre ce dont les cellules immunitaires ont besoin pour une fonction optimale ".
Quelle suite va être donnée?
Les résultats ont été rendus possibles grâce à une nouvelle méthode mise au point en consultation avec son collaborateur Ralph DeBerardinis, M.D., Ph.D., qui a permis à Jones et ses collègues de cartographier la manière dont les cellules T utilisent les nutriments dans des organismes vivants. Ils ont mis au point d'une méthode de perfusion 13C pour étudier le métabolisme des cellules T in vivo
"A l'avenir, cette nouvelle technique de cartographie sera d'une valeur inestimable dans la poursuite d'études sur des maladies spécifiques", a déclaré Eric Ma, Ph.D., premier auteur de l'étude et chercheur postdoctoral dans le laboratoire de Jones.
À l’avenir, l’équipe prévoit de concevoir des études sur l’homme afin de mesurer la manière dont les cellules T utilisent le glucose et d’autres nutriments lorsqu’elles réagissent à des agents pathogènes ou à d’autres atteintes telles que des blessures ou des maladies telles que le cancer.