De l'immunothérapie à la demande
Nos lecteurs assidus savent que ce site contient un générateur de peptides servant à concevoir des vaccins simples, peu coûteux et personnalisés contre le cancer. Des scientifiques pensent qu'il est possible d'utiliser un système sur le même principe, mais beaucoup plus efficace.
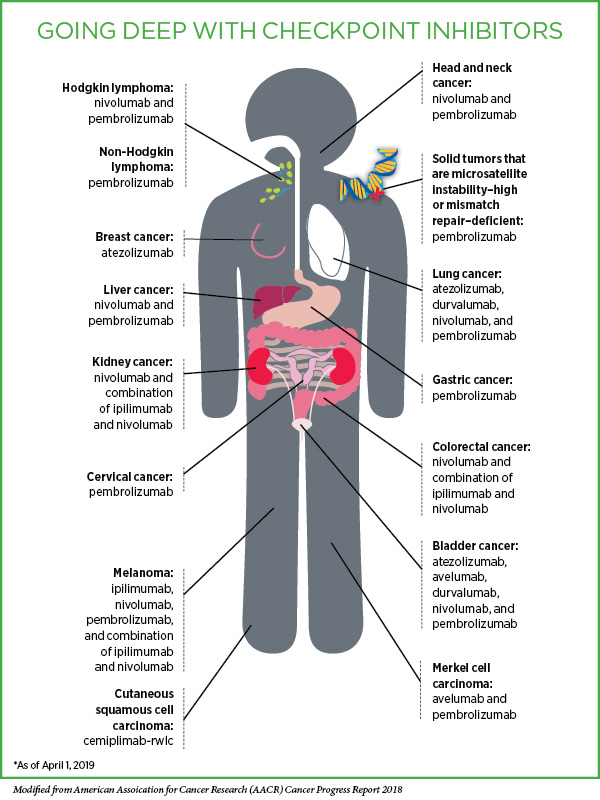
Les inhibiteurs à point de contrôle ne sont pas efficaces pour de nombreux patients
Les immunothérapies à inhibiteurs de point de contrôle révolutionnent le traitement du cancer. Cependant, même dans les cancers les plus sensibles, une part substantielle (50–80%) des patients a une réponse positive faible à nulle. Une découverte surprenante dans l'analyse de ces patients était que l'un des meilleurs corrélats de réponse était le nombre total de néo-antigènes dans la tumeur.
Fondements de la nouvelle proposition
Lorsque des informations sont transférées de l'ADN à l'ARN dans les cellules cancéreuses, des erreurs surviennent fréquemment, entraînant la production de protéines pouvant être reconnues par le système immunitaire. Pour les scientifiques de l’Institut Biodesign de l’Université d’Arizona State, ces protéines, appelées antigènes spécifiques du cancer, sont importantes, car elles peuvent être utilisées pour concevoir des vaccins capables de traiter ou de prévenir la progression tumorale.
Le point commun de toutes les mutations de tumeurs cancéreuses est la fabrication de néo-antigènes, ou de petits fragments de protéines appelés peptides, formés à l'intérieur d'une cellule cancéreuse, que le système immunitaire de l'hôte n'avait encore jamais vu. Ces peptides aberrants, présents uniquement dans les cellules cancéreuses, peuvent stimuler le système immunitaire grâce à un vaccin. Ils proposent que les erreurs de mal épissage et de transcription d'ARN, en particulier des INDEL des MS dans les régions codantes, dans les cellules cancéreuses pourraient également être une source de néo-antigènes.
Ces erreurs commises par les cellules cancéreuses peuvent servir à élaborer un vaccin contre certains cancers
"Dans une cellule cancéreuse, il s'avère que tous les niveaux de transfert d'information de l'ADN vers l'ARN vers la protéine deviennent plus sujets aux erreurs", a déclaré Johnston. "Nous avons proposé que ces erreurs commises dans les cellules cancéreuses puissent également constituer la source d'un vaccin contre le cancer."
Une erreur de "décalage de cadre" ou "d'épissage" se produit lorsque l'information de l'ADN d'un gène est mal traitée lors de la fabrication de l'ARN, dans un processus cellulaire de base appelé transcription et épissage de l'ARN.
Pour la plupart, ces altérations peuvent être gérées et nettoyées par la cellule, sans jamais être exposées au système immunitaire. Au fur et à mesure que le cancer progresse, en raison de l'augmentation du nombre d'erreurs, les déchets protéiques s'accumulent plus rapidement, submergeant la cellule et les protéines aberrantes sont exposées et reconnues par la cellule immunitaire.
"Celles-ci submergent les systèmes de contrôle de la qualité d'une cellule, générant des erreurs dans l'ARN et les protéines libérées par la cellule cancéreuse, auxquelles le système immunitaire peut réagir", a déclaré Johnston.
Un nouvel outil
Pour découvrir les néo-antigènes dans les tumeurs, l'équipe de Johnston a développé un nouveau type de puce (array). Ils ont fabriqué des puces présentant les 200 000 néo-antigènes possibles à cinq cancers courants, leur permettant ainsi de rechercher simplement les anticorps présents dans le sang prélevé par les patients. Ceci est beaucoup plus simple que la pratique courante qui consiste à obtenir l’ADN de la tumeur et à le séquencer, un point de départ pour les «vaccins anticancéreux personnels» que de nombreuses entreprises poursuivent actuellement.
Cet ensemble permet de détecter tous les peptides de décalage de trame prédits possibles que toute cellule tumorale pourrait potentiellement produire. Ils ont personnalisé cette puce, qui contenait près de 400 000 peptides, et les a analysés avec les échantillons de sang de patients cancéreux (et des échantillons sains servant de contrôle) pour rechercher les peptides présentant les anticorps les plus réactifs.
L'idée de base consiste à fabriquer un vaccin contenant de multiples (jusqu'à 100) peptides anormales.
Intérêt de ce nouveau type d'immunothérapie
"Les vaccins personnels contre le cancer sont compliqués et coûteux", a déclaré Johnston. "De plus, environ 40% seulement des tumeurs ont suffisamment de mutations dans l'ADN pour pouvoir fabriquer un vaccin. Nous avons découvert que même les "tumeurs froides" au niveau de l'ADN font beaucoup d'erreurs au niveau de l'ARN. Les peptides que nous générons sont beaucoup plus immunogènes que les mutations ponctuelles utilisées dans les vaccins anticancéreux personnels. Plus important encore, nous pouvons fabriquer des vaccins standards pour des vaccins thérapeutiques ou même préventifs beaucoup moins coûteux."
Un vaccin qui permet de lutter contre le développement d'une résistance
Il devrait être difficile pour les cellules tumorales de s’éloigner du vaccin, car ces FS sont des variants et non des mutations héréditaires. En particulier, si l'antigène FS était produit dans l'ARN d'un gène essentiel, les cellules tumorales devraient restreindre la présentation du MHC ou créer un environnement immunosuppresseur pour échapper à une réponse immunitaire.
En résumé, les scientifiques ont découvert une autre classe de néo-antigènes qui pourrait être utile pour développer différents types de vaccins anticancéreux. Ils ont également créé un format matriciel permettant de détecter directement les réponses immunitaires à ces antigènes tumoraux.
Quel suite va être donné à ces travaux
Trop souvent les laboratoires universitaires arrêtent leur recherche quand ils peuvent déposer un brevet, dans l'espoir très incertain, qu'une grande entreprise offrira un pont d'or pour acheter ce brevet. Cet espoir est très souvent déçu, tout simplement parce que les brevets issues de la recherche académique ne sont pas reproductible, mais aussi parce qu'ils ne répondent pas à un grand nombre de problématiques médicales et réglementaires. C'est normalement le rôle des biotech de régler ces difficultés pour rendre un procédé attractif pour les grandes sociétés. Nos scientifiques, eux, sont beaucoup plus adroits. Ils ont récemment lancé un grand essai clinique sur un vaccin prophylactique pan-cancéreux contre le cancer du chien, financé par l'Open Philanthropy Project. Si cela réussit, Johnston est impatient de passer aux premiers essais cliniques sur l'homme.
En ce qui concerne ce site, nous pourrions éventuellement concevoir un générateur de peptides basé sur ce principe. Nhésitez pas à nous contacter à ce sujet. "contact at padiracinnovation dot org"