La maladie de Parkinson se caractérise par une perte de neurones dopaminergiques dans la substantia nigra. Il n’existe aucun traitement pouvant améliorer le cours de la maladie de Parkinson. Alors que la plupart des stratégies de traitement visent à prévenir la perte neuronale ou à protéger les circuits neuronaux, une alternative potentielle, mais non explorée jusqu’à maintenant, consiste à remplacer les neurones perdus pour ainsi reconstruire les circuits neuronaux altérés.
Compte tenu de la plasticité de certaines cellules somatiques, les approches de transdifférenciation pour changer le destin des cellules (in situ pour échapper au système immunitaire), ont pris de l’ampleur. Dans le cerveau de souris, la plasticité des cellules gliales a ainsi été mise à profit pour générer de nouveaux neurones ayant montrés une amélioration de maladie chez les animaux modèles.
La plupart des reprogrammations in vivo reposent sur l’utilisation de facteurs de transcription spécifiques à la lignée de cellule considérée. Cette étude montre qu’il existe d’autres moyens pour atteindre cet objectif.
Des chercheurs de l'Université de Californie ont développé un virus non infectieux qui porte une séquence d’oligonucléotides antisense conçue pour se lier spécifiquement à l’ARN codant pour la protéine PTB, la dégradant ainsi, l’empêchant d’être traduit en une protéine fonctionnelle. Les oligonucléotides antisense sont une approche thérapeutique éprouvée.
La régulation négative séquentielle de PTB et nPTB se produit naturellement pendant la neurogenèse, et une fois déclenchée, les boucles d’expression génique régulées par PTB et nPTB deviennent auto-renforçantes. En modulant les deux boucles, la régulation négative séquentielle de PTB et nPTB permet de génèrer des neurones fonctionnels à partir de fibroblastes humains.
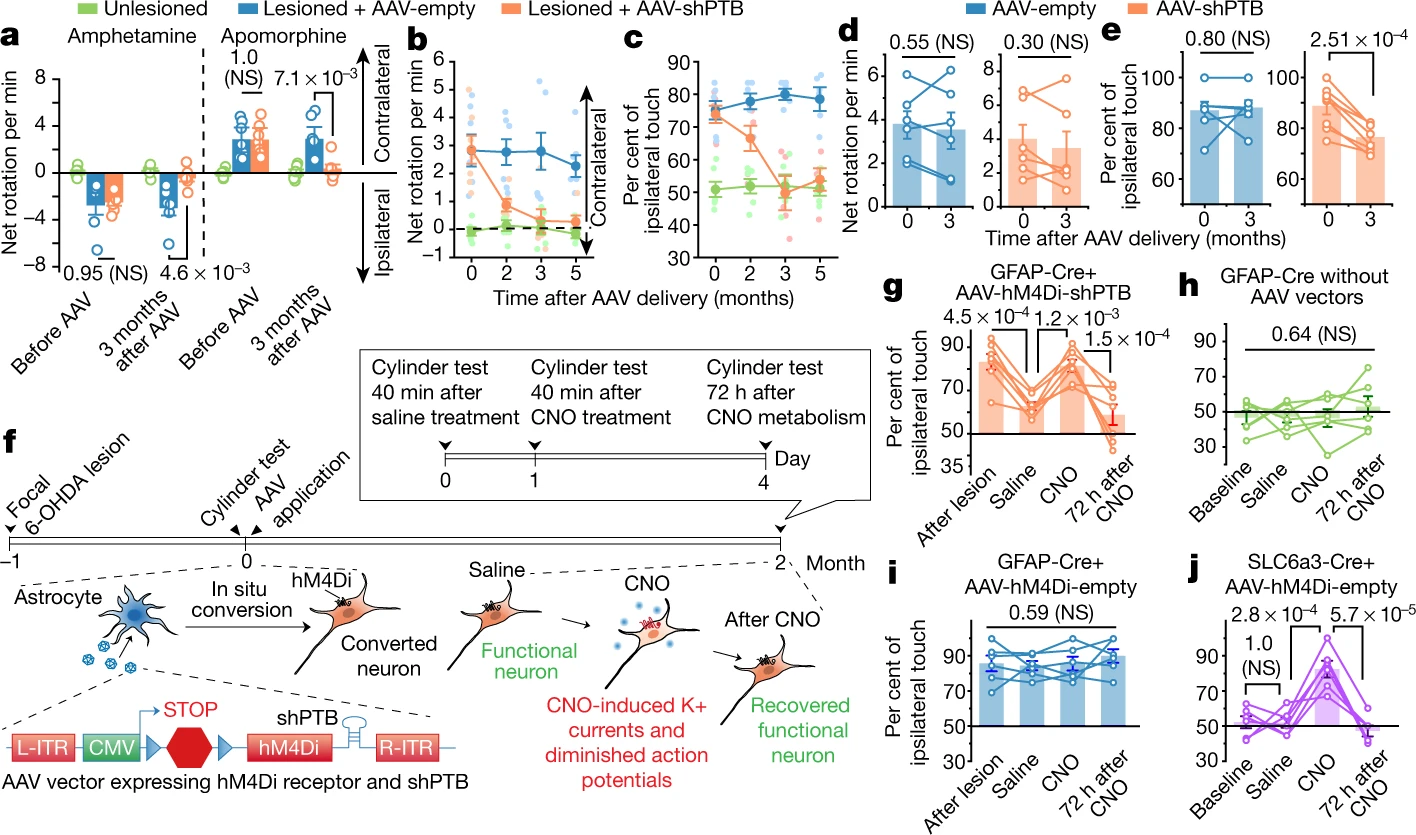
Les astrocytes offrent plusieurs avantages pour la reprogrammation in vivo dans le cerveau. Ces cellules non neuronales sont abondantes, prolifèrent en cas de blessure et sont très plastiques. Elles peuvent adopter différents phénotype, voire être reprogrammées dans un type de cellule très différent. Les astrocytes peuvent être convertis en différents sous-types neuronaux, suivant leur région d’origine dans le cerveau.
Ici, les scientifiques rapportent une conversion efficace en seule étape, d’astrocytes issus d’humains et de souris, en neurones fonctionnels. Ceci en appauvrissant la protéine de liaison à l’ARN PTB (également connue sous le nom de PTBP1). Les cellules cibles de cette conversion sont les neurones dopaminergiques (DA) dans la substantia nigra, c’est-à-dire ceux qui deviennent non fonctionnels dans la maladie de Parkinson. En appliquant cette approche, les scientifiques ont démontré la conversion progressive des astrocytes en nouveaux neurones capables d’innerver et repeupler les circuits neuronaux de la la substantia nigra. Ces neurones dopaminergiques induits par l’épuisement du PTB rétablissent puissamment la dopamine striatale, reconstituent le circuit nigrostriatal et inversent les phénotypes moteurs de type maladie de Parkinson.
Chez les souris traitées, un sous-ensemble d’environ 30% des astrocytes, se sont convertis en neurones, augmentant ainsi le nombre total de neurones. Les niveaux de dopamine ont été restaurés à un niveau comparable à celui des souris normales. De plus, les neurones se sont développés et ont envoyé leurs processus dans d’autres parties du cerveau. Il n’y a eu aucun changement chez les souris témoins.
Les souris traitées ont récupérées leur vitalité avec un seul traitement et sont restées complètement indemnes de symptômes de la maladie de Parkinson pour le reste de leur vie. En revanche, les souris témoins n’ont montré aucune amélioration.
Pour expérimenter la conversion des astrocytes du mésencéphale en neurones dopaminergiques, les scientifiques ont utilisé un modèle de la maladie de Parkinson chimiquement induit chez la souris. Le modèle utilisé par l’équipe ne résume pas parfaitement toutes les caractéristiques essentielles de la maladie de Parkinson. À l’avenir, les scientifiques utiliseront un modèle génétique animal plus coûteux de Parkinson.
On peut se demander si cette thérapie est transposable à d’autres maladies neurodégénératives. Cependant la maladie de Parkinson est caractérisée par une atteinte dans une région très spécifique du cerveau. Au contraire dans la maladie d’Alzheimer l’atteinte est globale au cerveau et dans le cas de la sclérose latérale amyotrophique les neurones impliqués sont les neurones moteurs mais cela recouvre une zone géographique considérable, qui s’étend largement hors du système immunitaire central.

