Les neutrophiles sont la première ligne de défense du système immunitaire contre l'infection et on pense généralement qu'ils tuent les agents pathogènes envahisseurs grâce à deux stratégies: l'engloutissement des microbes et la sécrétion d'antimicrobiens. En 2004, une nouvelle fonction a été identifiée: la formation de NET Les NET sont des filaments très fins visibles en microscopie électronique à balayage. Les fibres sont décorées de particules globulaires et regroupées pour former des structures plus complexes.
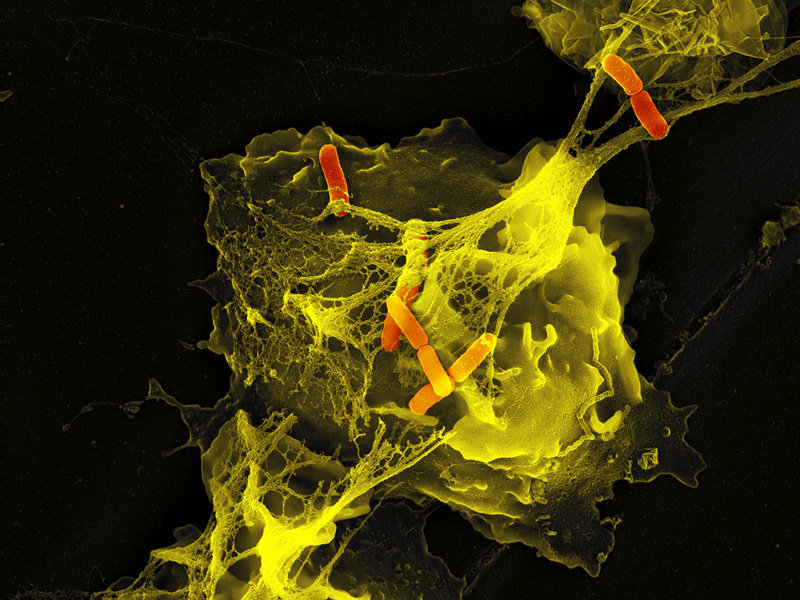 Source: Max Planck institute for infection biology
Source: Max Planck institute for infection biology
Les NET permettent une concentration locale élevée de composants antimicrobiens et lient, désarment et tuent non seulement les bactéries mais aussi les champignons pathogènes. En plus de leurs propriétés antimicrobiennes, les NET peuvent servir de barrière physique qui empêche la propagation ultérieure des agents pathogènes.
Il a été démontré que les NET se forment dans les vaisseaux sanguins, en particulier dans les capillaires pulmonaires et les sinusoïdes hépatiques. La formation intra-vasculaire de NET est étroitement contrôlée et est régulée par les plaquettes, qui détectent une infection sévère puis se lient aux neutrophiles et les activent pour former des NET. La formation de NET induite par les plaquettes, se produit en quelques minutes et le NET peut alors intercepter les bactéries en circulation lorsqu'elles traversent les vaisseaux.
Les NET pourraient cependant avoir un effet délétère sur l'hôte, car l'exposition extracellulaire des complexes d'histones pourrait jouer un rôle lors du développement de nombreuses maladies.
Les auteurs d'une étude publiée dans Nature Immunology, ont identifié un programme intrinsèque cellulaire qui modifie le protéome des neutrophiles et provoque la perte progressive de la teneur en granules et la réduction de la capacité de formation de NET.
https://www.ncbi.nlm.nih.gov/pubmed/31932813
Il est reconnu depuis longtemps que de multiples processus inflammatoires chez l'homme présentent une périodicité circadienne, et des modèles expérimentaux ont corroboré que non seulement le début de l'inflammation, mais aussi la gravité des événements inflammatoires manifestent des oscillations diurnes. Ces événements sont souvent causés par l'activation des neutrophiles et par la thrombose, qui à son tour peut être exacerbée en présence de neutrophiles ou de NET. Ainsi, les résultats des auteurs, qui sont obtenus dans le contexte d'une inflammation pulmonaire aiguë, peuvent s'étendre à d'autres conditions inflammatoires et thrombotiques.
Les changements de protéome sont entraînés par CXCR2 et Bmal1. Les changements diurnes dans la transcription et la migration des neutrophiles sont contrôlés par un mécanisme intrinsèque cellulaire, dans lequel l'expression de la chimiokine Cxcl2 est régulée par la protéine d'horloge moléculaire Bmal1 et conduit à l'activation diurne autonome des cellules des neutrophiles par signalisation via CXCR2.
Le programme cellulaire intrinsèque qui modifie le protéome des neutrophiles dans la circulation sanguine, entraîne également la perte progressive de la teneur en granulés et la réduction de la capacité de formation NET.
Les changements dans le protéome, le contenu des granules et la formation de NET indiquent donc une stratégie possible pour "désarmer" les neutrophiles.
