On sait depuis 2017 que certaines personnes atteintes de diabète de type 2 ont un risque plus élevé de développer la maladie d'Alzheimer.
Une variante de l'un des principaux gènes impliqués dans la maladie d'Alzheimer: APOE4, semble interférer avec la capacité des cellules cérébrales à utiliser l'insuline, ce qui peut éventuellement provoquer le stress (en quelque sorte l'état de famine) et la mort des cellules nerveuses. Officieusement, on appelle parfois cela: Le diabète de type 3.
L'insuline régule le métabolisme des glucides, des lipides et des protéines en favorisant l'absorption du glucose du sang par le foie, les graisses et les cellules musculaires squelettiques.
Des concentrations élevées d'insuline dans le sang inhibent fortement la production et la sécrétion de glucose par le foie. L'insuline circulante affecte également la synthèse des protéines (augmentation de la masse tissulaire) dans une grande variété de tissus.
A l'inverse, de faibles niveaux d'insuline dans le sang ont l'effet inverse en favorisant un catabolisme (fonte des tissus) généralisé, en particulier de la graisse corporelle de réserve.
On pense que chez personnes diabétiques, l'utilisation ou la signalisation de l'insuline par leur cerveau ne fonctionne pas. Leur risque de développer la maladie d'Alzheimer est environ 10 à 15 fois plus élevé.
Ce nouvel article de Gemma Salvadó et ses collègues apporte davantage d'informations sur ce sujet.
L'activation gliale (les cellules nerveuses autres que les neurones) est l'un des premiers mécanismes à être altérés dans la maladie d'Alzheimer.
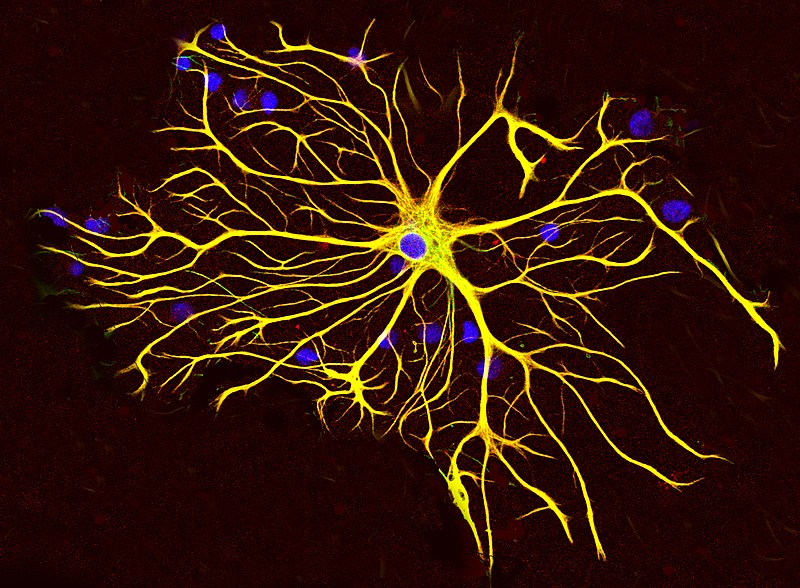
La protéine acide fibrillaire gliale (GFAP) est une protéine protéine de filament intermédiaire (IF) qui est exprimée par de nombreux types de cellules du système nerveux central (SNC), y compris les astrocytes.
Il existe de multiples troubles associés à une mauvaise régulation de la GFAP, et une blessure peut provoquer une réaction néfaste des cellules gliales. La cicatrisation gliale est une conséquence de plusieurs conditions neurodégénératives, ainsi que des blessures qui sectionnent le matériel neural. La cicatrice est formée par des astrocytes interagissant avec le tissu fibreux pour rétablir les marges gliales autour du noyau central de la lésion et est partiellement causée par une régulation à la hausse de la GFAP.
La protéine acide fibrillaire gliale est liée à l'astrogliose réactive (la destruction des astrocytes, des cellules nerveuses différentes des neurones) et peut être mesurée à la fois dans le liquide céphalo-rachidien et le sang.
Il a été suggéré que la GFAP plasmatique soit modifiée plus tôt dans la maladie d'Alzheimer que son homologue du liquide céphalo-rachidien.
Bien que les astrocytes consomment environ la moitié de l'énergie dérivée du glucose dans le cerveau, la relation entre l'astrogliose réactive et le métabolisme cérébral du glucose est mal comprise. Le fluorodésoxyglucose (FDG) est un analogue du glucose marqué avec un isotope émetteur de positrons (18F) qui permet de mesurer la consommation cérébrale régionale de glucose à l'aide de la tomographie par émission de positons (TEP).
Les auteurs espagnols visaient à étudier l'association entre l'absorption de fluorodésoxyglucose (FDG) et l'astrogliose réactive, au moyen de GFAP quantifié à la fois dans le plasma et le liquide céphalo-rachidien pour les mêmes participants. GFAP est une protéine de filament intermédiaire astrocytaire, principalement exprimée dans le cerveau.
La cohorte ALFA a caractérisé la maladie d'Alzheimer préclinique chez 2743 individus sans troubles cognitifs, âgés de 45 à 75 ans, et enrichie pour les antécédents familiaux de maladie d'Alzheimer sporadique. Dans cette cohorte de parents, 419 participants ALFA + ont été sélectionnés pour être préférentiellement porteurs d'APOE-ε4 et/ou pour être des enfants adultes de patients AD. Ces participants ont subi une évaluation plus complète incluant une ponction lombaire et une TEP Aβ et [18F]FDG.
Pour cette étude, les auteurs ont inclus 314 participants sans troubles cognitifs de la cohorte ALFA+, dont 112 étaient positifs à l'amyloïde-β. Les associations entre les marqueurs GFAP et l'absorption de [18F]FDG ont été étudiées. Les auteurs ont également cherché à savoir si ces associations étaient modifiées par le statut Aβ et tau.
La GFAP plasmatique était positivement associée à la consommation de glucose dans tout le cerveau, tandis que les associations de GFAP du liquide céphalo-rachidien avec l'absorption de [18F]FDG n'ont été observées que dans des zones spécifiques plus petites comme le pôle temporal et le lobe temporal supérieur.
Ces associations ont persisté lors de la prise en compte des biomarqueurs de la pathologie Aβ, mais sont devenues négatives chez les participants Aβ-positifs et tau-positifs dans des domaines similaires de l'hypométabolisme lié à la maladie d'Alzheimer.
Une réactivité astrocytaire plus élevée, probablement en réponse aux changements pathologiques précoces de la maladie d'Alzheimer, est liée à une consommation de glucose plus élevée. Avec l'apparition de la pathologie tau, le découplage observé entre les biomarqueurs astrocytaires et la consommation de glucose pourrait indiquer une incapacité à maintenir les demandes énergétiques plus élevées requises par les astrocytes réactifs.
