La sclérose latérale amyotrophique est une maladie hétérogène en termes de vitesse d'apparition et de progression, y compris chez les porteurs des mêmes mutations génétiques. Cette étude s'inscrit dans la continuité d'une décennie de travail. Cette étude par des chercheurs Italiens, confirme qu'une analyse comparative entre les souris à progression rapide et progression lente ALS portant la même quantité de SOD1 mutant permet d'identifier les processus moléculaires régissant la variabilité de l'évolution de la maladie.
Même si les souris de laboratoire ont un génome commun, il existe de nombreuses souches différentes qui réagissent très différemment à divers événements. Par exemple, certaines souris avec la même mutation peuvent avoir une progression très différente de la SLA. Les scientifiques préfèrent donc travailler avec des lignées de souris génétiquement bien connues car fortement consanguines.
Les souris transgéniques SOD1G93A sur fond C57 ou 129Sv ont respectivement un taux de progression de la maladie lent et rapide, ce qui évoque la variabilité observée chez les patients. Sur la base de preuves inférant l'influence active du muscle squelettique sur la pathogenèse de la sclérose latérale amyotrophique, les auteurs ont exploré si la dérégulation du muscle squelettique des membres postérieurs reflétait la différence phénotypique entre les deux modèles de souris.
Les souris à progression rapide présentaient une fonte musculaire brutale au début de la maladie, tandis que les souris à progression lente présentaient une atrophie musculaire présymptomatique qui restait stable tout au long de la progression de la maladie, suggérant l'activation de mécanismes compensatoires pouvant retarder l'apparition des symptômes.
Les scientifiques Italiens y soulignent que la myogenèse à médiation immunitaire couplée à une expression accrue des sous-unités AChR fœtales et à leur regroupement sont des processus essentiels dans l'homéostasie du muscle squelettique. Le curare, l'hexaméthonium et les toxines présentes dans les venins de serpents et de crustacés bloquent les récepteurs nicotiniques de l'acétylcholine.
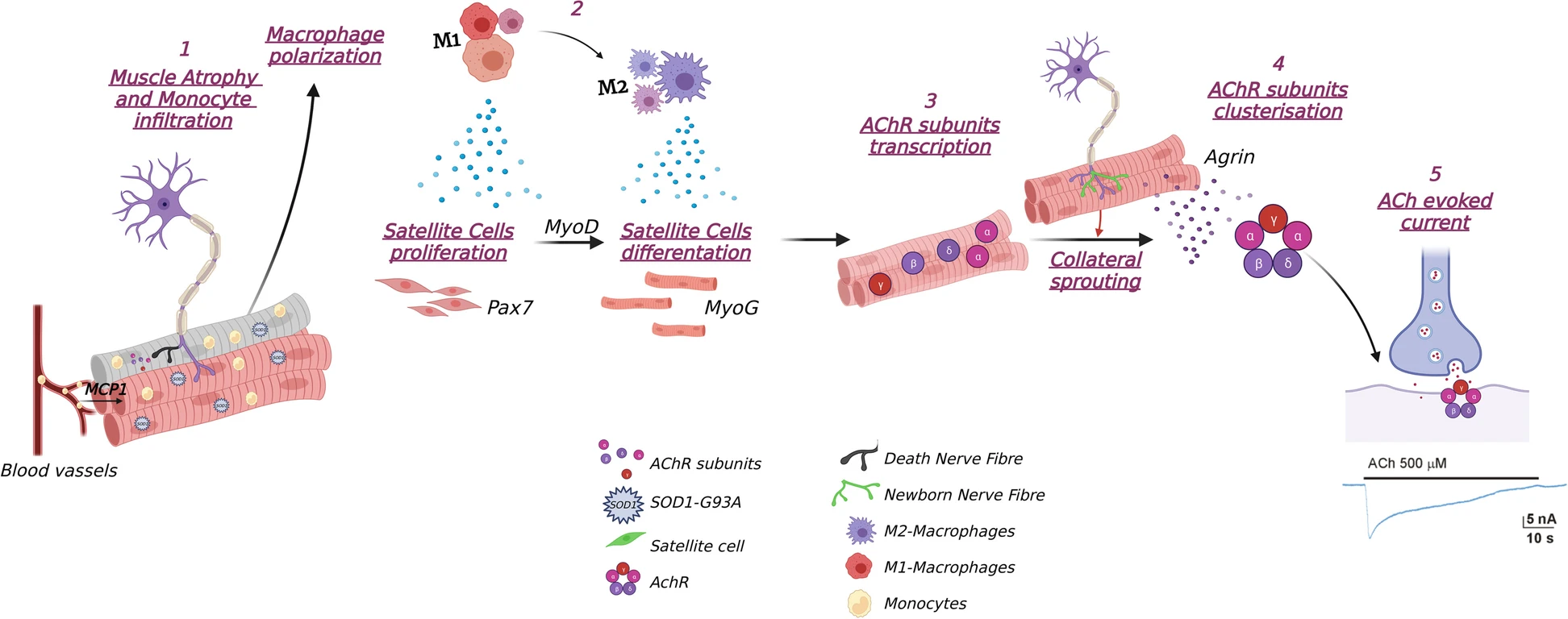
Au contraire, la dénervation musculaire précoce chez les souris à progression lente est essentielle pour déclencher un processus pro-régénératif musculaire à médiation immunitaire associé à la génération de nouvelles fibres musculaires et à l'augmentation de l'expression et du regroupement des récepteurs nicotiniques de l'acétylcholine fœtaux (AChR), qui améliorent considérablement les connexions de plaque motrice (NMJ) et retarder l'apparition du déficit de la force musculaire.
Ces processus sont de faible intensité chez les souris à progression rapide, où l'apparition rapide des symptômes lors de la dénervation musculaire est suivie d'une progression accélérée de la maladie et de la dégénérescence des motoneurone. Des découvertes récentes indiquent que la prolifération et la différenciation des cellules souches musculaires engagées dans la régénération musculaire sont sous le contrôle d'une réponse inflammatoire/immunitaire. Notamment, dans le muscle endommagé, les cellules immunitaires recrutées doivent passer d'un phénotype pro-inflammatoire à un phénotype anti-inflammatoire pour soutenir la formation et la croissance de nouvelles myofibres.
Les preuves indiquent que la neurodégénérescence rétrograde (du muscle vers les motoneurones) des motoneurones pourrait faire partie intégrante de la pathogenèse de la SLA dans un scénario de type privation ciblée où la pathologie primaire du muscle squelettique pourrait exacerber la perte de motoneurone. On sait que l'atrophie musculaire associée au démantèlement des Plaque motrice (NMJ) est l'un des premiers événements de la SLA.
Les scientifiques ont récemment démontré le rôle central du système immunitaire dans la promotion et la régulation de l'innervation et de la régénération des muscles squelettiques et, par conséquent, la vitesse de progression de la maladie. Leurs etudes mettent en évidence la contribution distincte de la réponse inflammatoire dans le SNC par rapport à la périphérie dans la SLA.
En effet, alors que l'activation aberrante des cellules gliales, l'infiltration des lymphocytes T et la libération de molécules pro-inflammatoires qui en résulte entraînent la neurodégénérescence de la moelle épinière, le succès de la régénération périphérique des axones et des muscles dépend des efforts coordonnés des cellules immunitaires qui, en plus d'éliminer les débris cellulaires, favorisent la cicatrisation.
La stimulation électrique à basse fréquence des muscles des membres postérieurs du rat, endommagés par des efforts musculaires, induit une augmentation des facteurs myogéniques et de l'activation du cellules souches musculaires conduisant à la régénération musculaire.
Les scientifiques ont précédemment signalé une différence remarquable dans l'apparition de la maladie et la vitesse de progression des symptômes chez des souris transgéniques portant la même quantité de SOD1G93A humaine sur différentes souches (C57BL/6JOlaHsd ou 129/SvHsd). Ils ont constaté que les deux modèles de souris présentaient une tendance similaire dans la perte de motoneurone de la colonne vertébrale mais montraient une différence dans le taux de fonte musculaire au cours de la progression de la maladie.
Les découvertes des auteurs mettent en évidence le rôle central du muscle squelettique dans la sclérose latérale amyotrophique, en fournissant de nouvelles informations sur les mécanismes sous-estimés de la maladie se produisant à le système nerveux périphérie. Dans une perspective de traitement multimédicamenteux visant à contrer la nature multisystémique de la SLA, une approche bien conçue pour cibler le muscle squelettique pourrait être une stratégie supplémentaire pour préserver l'ensemble de l'unité motrice.
