La progression des traits liés au vieillissement varie considérablement selon les individus, influencée par leur environnement, leur mode de vie et leur génétique. La notion de vieillissement biologique plutôt que chronologique, affirme que le vieillissement varie pas seulement le passage du temps mais aussi avec celui de l'organisme. Dans cette nouvelle étude, Michael Petr, Rafael de Cabo et ses collègues ont effectué des tests physiologiques et fonctionnels tout au long de la durée de vie des souris mâles de type C57BL/6N. La souris C57BL/6, qui peut vivre jusqu'à 4 ans, présente de nombreuses caractéristiques inhabituelles pour une souris de laboratoire: elle est exceptionnellement sensible à la douleur et au froid, et les médicaments analgésiques y sont moins efficaces. Contrairement à la plupart des souches de souris, ce type de souris est plus sensible aux addictions, à l'athérosclérose et la perte auditive avec l'âge.
En parallèle des tests fonctionnels, les scientifiques ont réalisés des analyses métabolomiques du sérum, du cerveau, du foie, du cœur et des muscles squelettiques afin d'identifier les signatures associées à l'âge.
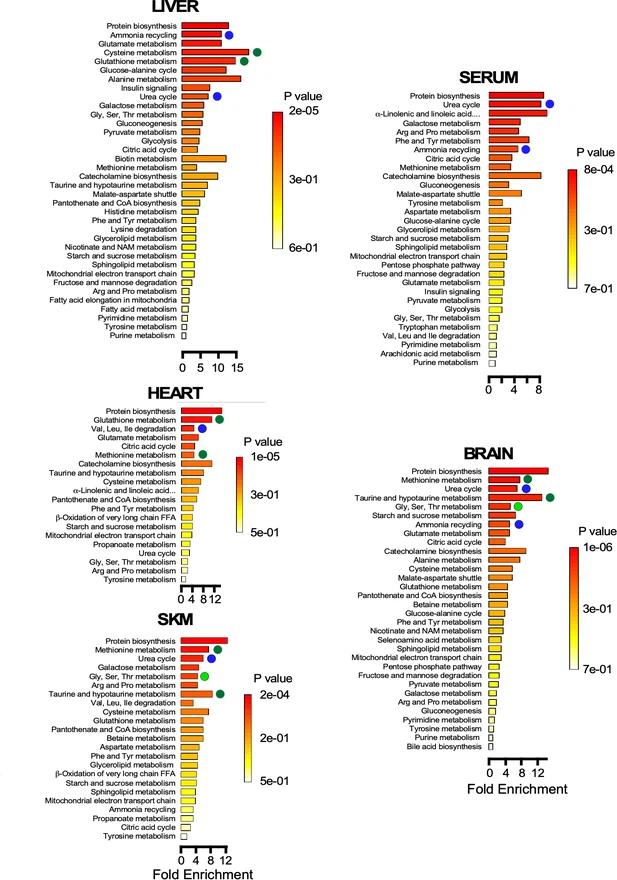 Les auteurs ont effectué une caractérisation approfondie de ces différences parmi trois groupes d'animaux: Jeunes, adultes et vieux.
Les auteurs ont effectué une caractérisation approfondie de ces différences parmi trois groupes d'animaux: Jeunes, adultes et vieux.
Cette analyse a démontré que: (i) la diminution de la vitesse de marche est un biomarqueur fonctionnel majeur du vieillissement chez la souris; (ii) la détérioration de l'activité locomotrice est associée à une augmentation spectaculaire du coût énergétique de l'activité physique à partir de l'âge de 19 mois environ, et s'accompagne d'une diminution soutenue de la capacité de travail;
Pour explorer davantage les changements moléculaires qui peuvent contribuer ou résulter de ces modifications, les scientifiques ont effectué une analyse métabolomique dans un certain nombre de tissus métaboliques clés et ont montré que: (i) différents organes remodèlent leur métabolisme en réponse à des demandes fonctionnelles spécifiques, par exemple l'approvisionnement en énergie et la désintoxication. (ii) l'épuisement du glucose, du 3-HB et du glycerol dans le sérum des souris agées montre une contribution réduite du foie et du tissu adipeux, aux autres organes; (ii) le vieillissement chez la souris favorise la modulation à la hausse du métabolisme du glucose dans les muscles cardiaques et squelettiques ainsi que dans le foie, où la gluconéogenèse et le cycle de l'urée sont également améliorés. Il y a un schéma similaire mais moins prononcé dans le cerveau.
Les auteurs ont ensuite évalué les associations entre les métabolites et les paramètres phénotypiques en sélectionnant les 24 métabolites les plus représentatifs indépendamment de l'âge et de l'organe. Les principaux résultats ont montré que la variance du coût énergétique et du rapport d'échange respiratoire peut être expliquée par un modèle distinct de remodelage métabolique dans le foie (par exemple, métabolisme mixte du glucose, des lipides et des acides aminés), des muscles cardiaques et squelettiques (par exemple, glucose et lipides), et cerveau (mélange d'acides aminés en plus du glucose et du catabolisme corporel cétonique).
L'augmentation de la demande énergétique a suscité une utilisation de plus en plus mixte des substrats (glucose, lipides, acides aminés) conduisant à une augmentation du stress oxydatif dans les organes qui ont une capacité antioxydante plus faible par rapport au cœur et au foie.
L'accumulation de graisse viscérale est associée à la résistance à l'insuline, tandis que la graisse sous-cutanée joue un rôle dans la réduction des niveaux d'insuline et l'amélioration de la sensibilité à l'insuline. En effet, l'augmentation du pourcentage de graisse corporelle des souris jeunes aux souris adultes coïncidait avec un rapport graisse sous-cutanée / viscérale plus élevé, ce qui, à son tour, était associé à une baisse significative des taux d'insuline circulante et de la résistance à l'insuline.
Les auteurs supposent que les vieux animaux, peuvent moins compter sur l'oxydation des graisses (en utilisant les graisses stockées) et plus sur l'utilisation moins efficace des glucides pour les besoins énergétiques.
Cette utilisation de plus en plus mixte du glucose et des lipides a conduit à une tendance vers une plus grande abondance de méthionine sulfoxyde et une déplétion en glutathion en réponse à une augmentation du taux d'échange respiratoire dans le cœur et le foie, alors que le cerveau avait nettement moins de méthionine sulfoxyde, mais une plus grande accumulation de méthionine et de nicotinamide par rapport à glutathion. Ce schéma est cohérent avec un stress oxydatif systémique et une capacité antioxydante plus faible.
Ensemble, ces données suggèrent qu'à mesure que les souris vieillissent, des organes tels que le foie et le cœur, qui sont exposés à un stress oxydatif plus élevé en raison de leur fonction (détoxification du foie et génération d'énergie dans le cœur), remodèlent leur métabolisme vers une expression plus élevée / l'activité des voies métaboliques liées à l'oxydoréduction, par exemple, le pentose phosphate, la récupération NAD + et la transsulfuration. À l'inverse, le muscle squelettique et le cerveau ne semblent pas capables de remodeler ces voies, devenant ainsi plus vulnérables à un stress oxydatif accru avec le vieillissement. Ce modèle métabolique est en accord avec l'idée de différents taux de vieillissement parmi les organes.
