Plusieurs articles sont parus récemment qui devraient faire réfléchir l’industrie pharmaceutique quant à l’intérêt de thérapies supprimant ou diminuant l’expression de gènes.
C’est le cas par exemple de Biogen qui a quatre thérapies de ce type contre la SLA. C'est aussi le cas des nombreuses proposition d'immunothérapies, contre des protéines humaines. On a évidemment en mémoire les centaines d'essais cliniques infructueux contre la SLA ou Parkinson, et les 2500 essais infructueux contre la maladie d'Alzheimer.
Comment en est-on arrivé là?
Dans les 30 dernières années de nombreuses maladies génétiques, notamment la maladie de Huntington, la maladie d'Alzheimer, la maladie de Parkinson et la sclérose latérale amyotrophique (SLA), ont été corrélées à des altérations de l'ADN, ce qui entraîne des séquences d'ARN incorrectes et donc des protéines mal traduites.
Bien qu'initialement les scientifiques aient postulés un mécanisme de perte de fonction (la protéine mutée ayant perdue sa fonction). Au tournant du siècle ils se sont rendu compte que ce n'était pas une explication plausible, aussi ils ont exprimés l'hypothèse d'un gain de fonction. Ce qui est nettement plus difficile à réfuter. Mais cette hypothèse est séduisante car un mécanisme de gain de fonction peut être aisément supprimé avec un ASO ou une immunothérapie.
Cas d'un vaccin contre la protéine Tau
Par exemple, les résultats d'un essai de phase II d'AADvac - un vaccin contre les formes pathologiques de la protéine tau - ont été publiés le 14 juin dans Nature Aging par Petr Novak et ses collègues.
Ce vaccin a atteint son critère d'évaluation principal dans cette étude de phase II, il semble donc raisonnablement semble sûr. Il a également suscité des réponses en anticorps chez presque tous les participants, qui avaient reçu un diagnostic de maladie d'Alzheimer légère, et a atténué une augmentation progressive du NfL plasmatique au cours de l'essai de deux ans.
En analysant les prélèvements de liquide céphalo-rachidien effectués parmi un petit sous-ensemble de volontaires, les scientifiques ont pu confirmer que le vaccin avait réduit la concentration de protéine Tau dans le liquide céphalo-rachidien.
Hélas, comme d'habitude, le vaccin n'a pas ralenti le déclin cognitif des patients.
Cas d'un ASO contre C9orf72
Les thérapie oligonucléotides antisens sont des brins d'ARN qui empêchent la traduction protéique de certains brins d'ARN messager en se liant à eux, dans un processus appelé hybridation.
Des chercheurs dirigés par Rita Sattler du Barrow Neurological Institute à Phoenix et Robert Baloh du Cedars-Sinai Medical Center à Los Angeles ont ainsi réalisé des expériences de suppression du gène C9orf72 sur un modèle de souris de laboratoire qui reproduit la maladie d’Alzheimer, ou tout au moins l’apparition de plaques d’amyloides.
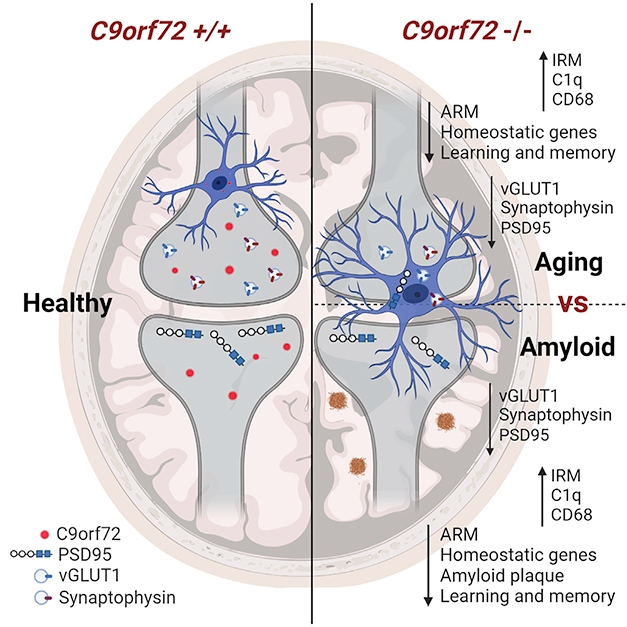
Baloh et ses collègues avaient déjà rapporté en 2016 que dans les cellules myéloïdes de souris knock-out C9orf72 et chez des porteurs de mutations de C9orf72 atteints de SLA/FTD, le signalement de la fonction lysosomale entraîne une escalade de l'interféron et une inflammation accrue.
Pour déterminer comment la carence en C9orf72 affecte la façon dont la microglie traite les plaques et les synapses, les chercheurs ont créé un modèle de souris Alzheimer déficient en expression C9orf72.
Chez des souris de 3 mois, qui commencent à développer des plaques amyloïdes, les scientifiques n'ont détecté aucun effet évident de la carence en C9orf72 sur le dépôt de plaque.
Cependant, à 6 mois, les souris dépourvues de C9orf72 avaient moins de plaques, et celles qui restaient étaient plus petites et plus compactes que les agrégats des souris témoins. Environ deux fois plus de microglies se sont rassemblées autour de chaque plaque que chez les souris témoins.
À la fin de l'expérience, les souris knock-out C9orf72 avaient moins de plaques, celles-ci étaient plus petites, mais les neurones avaient moins de synapses en raison de l'élagage trop zélé effectué par la microglie.
Conclusion
On ne peut que s’étonner de l’intérêt pour les thérapies supprimant les protéines d'origine ou diminuant l’expression protéique de gènes humains. Par quel saut conceptuel, ou par quel aveuglement est-on amené à penser qu’un mécanisme potentiellement délétère puisse devenir une thérapie à succès?

